题目内容
3.下列各组离子在溶液中能大量共存,且通入足量SO2气体后,最终溶液仍然保持澄清的离子组是( )| A. | Ba2+、Na+、Cl-、NO3- | B. | Fe3+、Ba2+、Cl-、I- | ||
| C. | Na+、NH4+、SO42-、OH- | D. | K+、Ca2+、HCO3-、Cl- |
分析 根据离子之间不能结合生成沉淀、气体、水、弱电解质等,不能发生氧化还原反应等,则离子大量共存,结合通入足量SO2气体不反应生成沉淀来解答.
解答 解:A.通入足量SO2气体,与Ba2+、NO3-发生氧化还原反应生成硫酸钡沉淀,故A错误;
B.Fe3+、I-发生氧化还原反应,不能共存,故B错误;
C.NH4+、OH-结合生成弱电解质,不能大量共存,故C错误;
D.该组离子之间不反应,可大量共存,且通入足量SO2气体后不反应生成沉淀,最终溶液仍然保持澄清,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
13.下列关于Na2CO3溶液的说法,正确的是( )
| A. | 相同温度下,Na2C03溶液中水的电离程度比纯水的电离程度小 | |
| B. | 相同温度下,Na2C03溶液中滴加酚酞呈红色,NaHC03溶液中滴加酚酞颜色更深 | |
| C. | VLamoL/L的Na2C03溶液中,若C032-的数目为NA;则Na+的数目大于2NA | |
| D. | CaC03在饱和Na2C03溶液中的KSP比在纯水中的KSP小 |
14.I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?═?I3-(aq).测得不同温度下该反应的平衡常数如下表:
下列说法正确的是( )
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1 000 | 850 | 690 | 625 | 400 |
| A. | 反应I2(aq)+I-(aq)?═?I3-(aq)的△H>0 | |
| B. | 利用该反应可以除去硫粉中少量的碘单质 | |
| C. | 在上述平衡体系中加入苯,平衡不移动 | |
| D. | 25℃时,向溶液中加入少量KI固体,平衡常数K小于690 |
18.在空气中久置会变色的强电解质是( )
| A. | 氯水 | B. | 氢硫酸 | C. | 烧碱 | D. | 绿矾 |
8.某溶液中可能含有H+、NH4+、Fe3+、CO32-、SO42-、NO3-中的几种,且各种离子浓度相等.加入铝片,产生H2.现往原溶液中逐滴加入Ba(OH)2溶液至过量,可能发生的离子反应是( )
| A. | H++NH4++2OH-→NH3+2H2O | |
| B. | Ba2++2OH-+SO42-+2H+→BaSO4↓+2H2O | |
| C. | 2Ba2++6OH-+2SO42-+2Fe3+→2BaSO4↓+2Fe(OH)3↓ | |
| D. | Ba2++2OH-+SO42-+NH4++H+→NH3+BaSO4↓+2H2O |
15. 钠及其化合物在生产和生活中有广泛的应用.完成下列计算:
钠及其化合物在生产和生活中有广泛的应用.完成下列计算:
(1)钠铝合金可作核反应堆的载热介质.取1.46g的钠铝合金放入水中,合金全部溶解,放出1.12L氢气(标准状况),则该钠铝合金的化学式为Na2Al.
(2)NaCN是一种剧毒的化工原料,可用双氧水处理含NaCN的废液,发生反应的方程式为:NaCN+H2O2+H2O=NaHCO3+NH3.若处理含NaCN 4.90g的废液,需用15%的H2O221.65mL.(已知15% H2O2的密度是1.047g/mL)(保留2位小数)
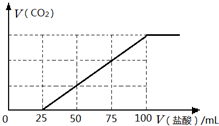
(3)向100mL NaOH溶液中通入一定量的CO2气体,充分反应后得到溶液A,再向A中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.试计算溶液A的溶质成份及其物质的量.
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠.通过计算,分析和比较上表3组数据,给出结论.
 钠及其化合物在生产和生活中有广泛的应用.完成下列计算:
钠及其化合物在生产和生活中有广泛的应用.完成下列计算:(1)钠铝合金可作核反应堆的载热介质.取1.46g的钠铝合金放入水中,合金全部溶解,放出1.12L氢气(标准状况),则该钠铝合金的化学式为Na2Al.
(2)NaCN是一种剧毒的化工原料,可用双氧水处理含NaCN的废液,发生反应的方程式为:NaCN+H2O2+H2O=NaHCO3+NH3.若处理含NaCN 4.90g的废液,需用15%的H2O221.65mL.(已知15% H2O2的密度是1.047g/mL)(保留2位小数)
(3)向100mL NaOH溶液中通入一定量的CO2气体,充分反应后得到溶液A,再向A中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.试计算溶液A的溶质成份及其物质的量.
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
12.如图表示酸雨的形成,关于酸雨下列说法正确的是( )


| A. | 酸雨的PH为5.6 | |
| B. | 酸雨的形成过程发生了氧化还原反应 | |
| C. | 酸雨的主要成分为氮、硫元素的氧化物 | |
| D. | 形成酸雨的主要原因是因为雷雨天气 |
13.某元素R的最高正价与最低负价的代数和为0,由此可以判断( )
| A. | R原子核外一定有4个电子层 | |
| B. | R原子最外层电子数一定为4 | |
| C. | R的气态氧化物比电子层数相同的其他非金属元素的气态氢化物稳定 | |
| D. | R元素气态氢化物的化学式为H2R |
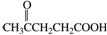 合成聚芳酯E的路线:
合成聚芳酯E的路线: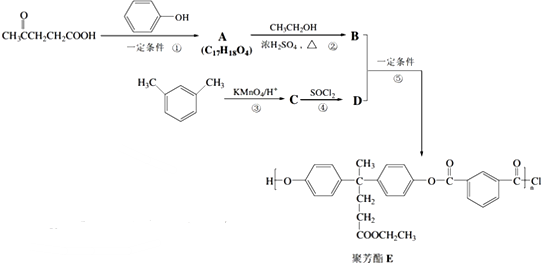
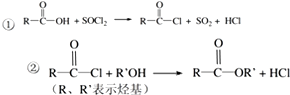
 .
. .
.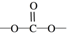 结构
结构 .
.