题目内容
20.实验室中钠应保存在煤油中,钠着火应用沙子灭火,过氧化钠可与CO2反应产生碳酸钠和氧气,所以过氧化钠可作供氧剂.过氧化钠与水反应,用一根带火星的木条伸入试管中,木条复燃,说明有氧气生成,向过氧化钠与水反应后的溶液中滴加酚酞,溶液变红色,说明有氢氧化钠生成.分析 钠是一种活泼金属,在空气中与氧气、水蒸气、二氧化碳发生化学反应,钠的密度大于煤油小于水,所以实验室中钠保存在煤油中,点燃条件下钠和二氧化碳能发生反应,钠着火应隔离空气,避免接触水、氧气、二氧化碳,一般应沙子盖灭,钠燃烧生成过氧化钠,过氧化钠和二氧化碳反应生成碳酸钠和氧气,常用来做潜水员的供氧剂,提供氧气,过氧化钠和水反应生成氢氧化钠和氧气,所以带火星的木条遇到生成的气体会复燃,生成的氢氧化钠是强碱,滴入酚酞试液,溶液会变红色.
解答 解:钠的密度大于煤油小于水,钠是一种活泼金属,在空气中与氧气、水蒸气、二氧化碳发生化学反应,所以实验室中钠保存在煤油中,点燃条件下钠和二氧化碳能发生反应,钠着火不能用灭火器灭火,应隔离空气,避免接触水、氧气、二氧化碳,一般应沙子盖灭,钠燃烧生成过氧化钠,过氧化钠和二氧化碳反应生成碳酸钠和氧气,2Na2O2+2CO2=2Na2CO3+O2,过氧化钠与人呼出的二氧化碳气体发生反应生成氧气,常用来做潜水员的供氧剂,提供氧气,过氧化钠和水反应生成氢氧化钠和氧气,2Na2O2+2H2O=4NaOH+O2,过氧化钠与水反应,用一根带火星的木条伸入试管中,带火星的木条遇到生成的氧气会复燃,向过氧化钠与水反应后的溶液中滴加酚酞,生成的氢氧化钠是强碱,所以溶液会变红色,
故答案为:煤油,沙子,碳酸钠和氧气,供氧剂,复燃,氧气,红色,氢氧化钠.
点评 本题考查了钠及其化合物的性质,理解反应实质和反应产物的性质,把握基础知识的准确性,题目较简单.

练习册系列答案
相关题目
10.一定体积0.01mol•L-1的稀硝酸恰好能氧化一定质量的铁、铝混合物.已知两种金属均被氧化为最高价态,还原产物只有NO.若用0.01mol•L-1NaOH溶液溶解相同质量的该混合物,当反应完全时所需氢氧化钠溶液的体积是稀硝酸的五分之一,则样品中铁、铝的物质的量之比为( )
| A. | 2:3 | B. | 1:3 | C. | 1:4 | D. | 5:3 |
11.对于反应①FeI2溶液与氯水反应;②Na2SO3溶液与稀盐酸反应;③Si与烧碱溶液反应; ④Fe与稀硝酸反应;改变反应物用量,不能用同一个离子方程式表示的是( )
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
8.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 无色溶液中:Na+、K+、AlO2-、NO3- | |
| B. | 强酸性溶液中:Fe2+、Na+、CH3COO-、Ca2+ | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、HCO3-、SO42- | |
| D. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- |
15.下列实验现象预测正确的是( )
| A. | 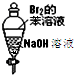 振荡后静置,溶液不再分层,且保持无色透明 | |
| B. |  铁片最终完全溶解,且高锰酸钾溶液变无色 | |
| C. |  微热稀HNO3片刻,溶液中有气泡产生,广口瓶内出现红棕色气体 | |
| D. |  当溶液至红褐色,停止加热,液体变为黄色 |
5.下列说法正确的是( )
| A. | 氢氧化镁、氢氧化钾、氢氧化铁、氢氧化镁等碱不溶于水,统称为难溶性碱 | |
| B. | 科学家合成和分离了超过4500万种物质.尿素是第一个人工合成的无机化合物,尿素的合成是无机化学发展过程中的重要里程碑和分水岭 | |
| C. | 金刚石、食盐、冰都属于晶体,有固定熔沸点,而石蜡、玻璃属于非晶体,一般不具备规则的几何外形 | |
| D. | 固体微粒排列紧密,在固定的位置上振动,几乎不能被压缩,而液体微粒可自由移动,易被压缩 |
12.用铝制易拉罐收集满CO2,快速加入过量NaOH浓溶液,立即把口封闭.发现易拉罐“咔咔”作响,并变瘪了;过一会儿,易拉罐又会作响并鼓起来.下列说法正确的是( )
| A. | 导致易拉罐变瘪的离子反应是:CO2+OH-═HCO3- | |
| B. | 导致易拉罐又鼓起来的反应是:Al3++3HCO3-═Al(OH)3+3CO2 | |
| C. | 上述过程中与NaOH溶液反应的物质有三种,且反应结束后的溶液显碱性 | |
| D. | 若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象 |
9.下列有关叙述正确的是( )
| A. | 加入催化剂会改变反应的焓变 | |
| B. | 已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2 | |
| C. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol | |
| D. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 |
10.已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变棕黄色.下列判断正确的是( )
| A. | 实验②证明Fe2+既有氧化性又有还原性 | |
| B. | 上述实验中,有一个氧化还原反应 | |
| C. | 实验①生成的气体不能使湿润的淀粉KI试纸变蓝 | |
| D. | 上述实验证明氧化性:MnO4->Cl2>Fe3+ |