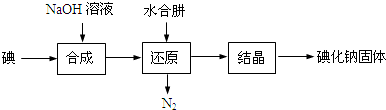
题目内容
8.有镁铝混合粉末10.2g,将它溶于500mL 4mol•L-1的盐酸中,当加入的氢氧化钠溶液1000mL时溶液中沉淀的质量最大,则氢氧化钠溶液的浓度的是( )| A. | 2mol•L-1 | B. | 0.5mol•L-1 | C. | 1mol•L-1 | D. | 3mol•L-1 |
分析 反应后溶液中再加入氢氧化钠溶液,要使产生的沉淀的质量最大,则沉淀为氢氧化镁与氢氧化铝,此时溶液为氯化钠溶液,根据钠离子与氯离子守恒计算氢氧化钠的物质的量,进而计算氧化钠溶液的浓度.
解答 解:要使产生的沉淀的质量最大,则沉淀为氢氧化镁与氢氧化铝,此时溶液为氯化钠溶液,根据钠离子与氯离子守恒可知:n(NaOH)=n(NaCl)=n(HCl)=0.5L×4mol/L=2mol,所以需氢氧化钠溶液的物质的量浓度为$\frac{2mol}{1L}$=2mol/L,
故选:A.
点评 本题考查化学方程式有关计算,明确酸碱恰好中和时沉淀质量最大及氢氧化铝能溶于强碱时解答本题的关键,注意利用守恒法计算解答.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
10.下列化学反应中,属于氧化还原反应的是( )
| A. | SO2+2NaOH═Na2SO3+H2O | |
| B. | SiH4+2H2O+8AgNO3═8Ag↓+SiO2↓+8HNO3 | |
| C. | Na2O+H2O═2NaOH | |
| D. | Al(OH)3+NaOH═Na[Al(OH)4] |
19.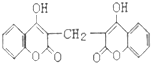 化学家从腐败草料中提取出双香豆素,结构简式如图.1mol双香豆素与NaOH溶液反应,最多可消耗NaOH的物质的量是( )
化学家从腐败草料中提取出双香豆素,结构简式如图.1mol双香豆素与NaOH溶液反应,最多可消耗NaOH的物质的量是( )
 化学家从腐败草料中提取出双香豆素,结构简式如图.1mol双香豆素与NaOH溶液反应,最多可消耗NaOH的物质的量是( )
化学家从腐败草料中提取出双香豆素,结构简式如图.1mol双香豆素与NaOH溶液反应,最多可消耗NaOH的物质的量是( )| A. | 4 mol | B. | 5mol | C. | 6 mol | D. | 8mol |
16.下列离子方程式书写不正确的是( )
| A. | 少量Mg(OH)2固体可溶于较浓的NH4Cl溶液中:Mg(OH)2+2NH4+═Mg2++2NH3•H2O | |
| B. | 在CuSO4溶液中加入PbS,可转变为铜蓝(CuS):Cu2++PbS═Pb2++CuS | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液至SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| D. | 向Na2S2O3溶液中滴加稀硫酸,溶液变混浊:S2O32-+2H+═S↓+SO2↑+H2O |
20.下列实验操作能够达到实验目的是( )


| A. | 实验室采用图①所示装置收集SO2 | |
| B. | 用图②所示装置,分离CCl4萃取I2水后的有机层和水层 | |
| C. | 除去NaHCO3溶液中的Na2CO3可加入Ca(OH)2溶液后过滤 | |
| D. | 称取0.40gNaOH,放入100mL容量瓶中,配制0.10mol•L-1的NaOH溶液 |
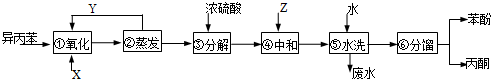
17.异丙苯 (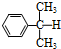 )氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下:
)氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下:
氧化: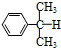 +O→
+O→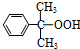 (异丙苯过氧氢)
(异丙苯过氧氢)
分解: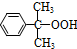 $→_{50-60℃}^{H+}$
$→_{50-60℃}^{H+}$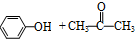 (丙嗣)
(丙嗣)
已知:
完成下列填空:
(1)X物质是氧气(或空气);Y物质是异丙苯.
(2)浓硫酸的作用是催化剂,其优点是用量少,可能的缺点是浓硫酸会使有机物发生脱水等副反应(浓硫酸与有机物混合放出大量热,使反应温度过高,不利于反应进行;或浓硫酸会腐蚀设备等)(写一条).
(3)Z物质最适宜选择c(选填编号).
a.NaOH b.Na2CO3 c.NaHCO3 d.CaCO3
(4)步骤⑥分馏,工业上在分馏塔中进行,如图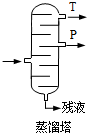 ,产品T是丙酮,
,产品T是丙酮,
请说明理由丙酮的沸点低.废水中苯酚的含量,可根据苯酚与溴水的反应,用以下方法测定:
①把20.00mL废水、20mLKBrO3和KBr混合溶液[其中:
c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L]置于锥形瓶中,再加入10mL6mol/L的盐酸,迅速盖好盖子,摇动锥形瓶.
②充分反应后,稍松开瓶塞,从瓶塞和瓶壁间缝隙迅速加入10%KI溶液10mL(过量),迅速加盖,充分摇匀.加入少许淀粉溶液.
③用0.0250mol/LNa2S2O3标准溶液滴定至终点.用去Na2S2O3溶液22.48mL.
(5)已知:BrO3-+5Br-+6H+→3Br2+3H2O;写出苯酚与浓溴水反应的化学方程式 ;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是溴易挥发.
;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是溴易挥发.
(6)已知:I2+2Na2S2O3→2NaI+Na2S4O6;滴定终点的现象是由蓝色变为无色(或白色浑浊)且半分钟内不变色;该废水中苯酚的浓度是0.0053mol/L(保留4位小数).
 )氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下:
)氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下:氧化:
 +O→
+O→ (异丙苯过氧氢)
(异丙苯过氧氢)分解:
 $→_{50-60℃}^{H+}$
$→_{50-60℃}^{H+}$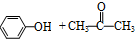 (丙嗣)
(丙嗣)
| 物质 | 丙酮 | 苯酚 | 异丙苯 |
| 密度(g/mL) | 0.7898 | 1.0722 | 0.8640 |
| 沸点/°C | 56.5 | 182 | 153 |
完成下列填空:
(1)X物质是氧气(或空气);Y物质是异丙苯.
(2)浓硫酸的作用是催化剂,其优点是用量少,可能的缺点是浓硫酸会使有机物发生脱水等副反应(浓硫酸与有机物混合放出大量热,使反应温度过高,不利于反应进行;或浓硫酸会腐蚀设备等)(写一条).
(3)Z物质最适宜选择c(选填编号).
a.NaOH b.Na2CO3 c.NaHCO3 d.CaCO3
(4)步骤⑥分馏,工业上在分馏塔中进行,如图
 ,产品T是丙酮,
,产品T是丙酮,请说明理由丙酮的沸点低.废水中苯酚的含量,可根据苯酚与溴水的反应,用以下方法测定:
①把20.00mL废水、20mLKBrO3和KBr混合溶液[其中:
c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L]置于锥形瓶中,再加入10mL6mol/L的盐酸,迅速盖好盖子,摇动锥形瓶.
②充分反应后,稍松开瓶塞,从瓶塞和瓶壁间缝隙迅速加入10%KI溶液10mL(过量),迅速加盖,充分摇匀.加入少许淀粉溶液.
③用0.0250mol/LNa2S2O3标准溶液滴定至终点.用去Na2S2O3溶液22.48mL.
(5)已知:BrO3-+5Br-+6H+→3Br2+3H2O;写出苯酚与浓溴水反应的化学方程式
 ;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是溴易挥发.
;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是溴易挥发.(6)已知:I2+2Na2S2O3→2NaI+Na2S4O6;滴定终点的现象是由蓝色变为无色(或白色浑浊)且半分钟内不变色;该废水中苯酚的浓度是0.0053mol/L(保留4位小数).