题目内容
17.异丙苯 (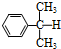 )氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下:
)氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下:氧化:
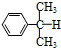 +O→
+O→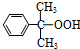 (异丙苯过氧氢)
(异丙苯过氧氢)分解:
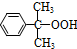 $→_{50-60℃}^{H+}$
$→_{50-60℃}^{H+}$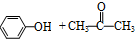 (丙嗣)
(丙嗣)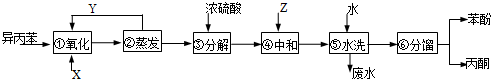
| 物质 | 丙酮 | 苯酚 | 异丙苯 |
| 密度(g/mL) | 0.7898 | 1.0722 | 0.8640 |
| 沸点/°C | 56.5 | 182 | 153 |
完成下列填空:
(1)X物质是氧气(或空气);Y物质是异丙苯.
(2)浓硫酸的作用是催化剂,其优点是用量少,可能的缺点是浓硫酸会使有机物发生脱水等副反应(浓硫酸与有机物混合放出大量热,使反应温度过高,不利于反应进行;或浓硫酸会腐蚀设备等)(写一条).
(3)Z物质最适宜选择c(选填编号).
a.NaOH b.Na2CO3 c.NaHCO3 d.CaCO3
(4)步骤⑥分馏,工业上在分馏塔中进行,如图
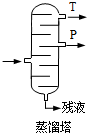 ,产品T是丙酮,
,产品T是丙酮,请说明理由丙酮的沸点低.废水中苯酚的含量,可根据苯酚与溴水的反应,用以下方法测定:
①把20.00mL废水、20mLKBrO3和KBr混合溶液[其中:
c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L]置于锥形瓶中,再加入10mL6mol/L的盐酸,迅速盖好盖子,摇动锥形瓶.
②充分反应后,稍松开瓶塞,从瓶塞和瓶壁间缝隙迅速加入10%KI溶液10mL(过量),迅速加盖,充分摇匀.加入少许淀粉溶液.
③用0.0250mol/LNa2S2O3标准溶液滴定至终点.用去Na2S2O3溶液22.48mL.
(5)已知:BrO3-+5Br-+6H+→3Br2+3H2O;写出苯酚与浓溴水反应的化学方程式
 ;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是溴易挥发.
;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是溴易挥发.(6)已知:I2+2Na2S2O3→2NaI+Na2S4O6;滴定终点的现象是由蓝色变为无色(或白色浑浊)且半分钟内不变色;该废水中苯酚的浓度是0.0053mol/L(保留4位小数).
分析 用异丙苯氧化法生产苯酚和丙酮,由给予的反应信息,异丙苯与氧气在反应器①中发生氧化反应生成 ,在②中蒸发分离出
,在②中蒸发分离出 ,未反应的异丙苯进行循环利用,
,未反应的异丙苯进行循环利用, 在③中在浓硫酸作催化剂条件下分解得到
在③中在浓硫酸作催化剂条件下分解得到 、
、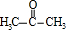 ,在④中加入Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后⑤中水洗涤,再经过⑥分馏得丙酮、苯酚,据此答题.
,在④中加入Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后⑤中水洗涤,再经过⑥分馏得丙酮、苯酚,据此答题.
解答 解:用异丙苯氧化法生产苯酚和丙酮,由给予的反应信息,异丙苯与氧气在反应器①中发生氧化反应生成 ,在②中蒸发分离出
,在②中蒸发分离出 ,未反应的异丙苯进行循环利用,
,未反应的异丙苯进行循环利用, 在③中在浓硫酸作催化剂条件下分解得到
在③中在浓硫酸作催化剂条件下分解得到 、
、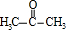 ,在④中加入Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后⑤中水洗涤,再经过⑥分馏得丙酮、苯酚,
,在④中加入Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后⑤中水洗涤,再经过⑥分馏得丙酮、苯酚,
(1)根据上面的分析可知,X物质是 氧气(或空气);Y物质是 异丙苯,
故答案为:氧气(或空气);异丙苯;
(2) 在③中在浓硫酸作催化剂条件下分解得到
在③中在浓硫酸作催化剂条件下分解得到 、
、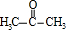 ,所以浓硫酸的作用是 催化剂,其优点是用量少,可能的缺点是 浓硫酸会使有机物发生脱水等副反应(浓硫酸与有机物混合放出大量热,使反应温度过高,不利于反应进行;或浓硫酸会腐蚀设备等),
,所以浓硫酸的作用是 催化剂,其优点是用量少,可能的缺点是 浓硫酸会使有机物发生脱水等副反应(浓硫酸与有机物混合放出大量热,使反应温度过高,不利于反应进行;或浓硫酸会腐蚀设备等),
故答案为:催化剂;浓硫酸会使有机物发生脱水等副反应(浓硫酸与有机物混合放出大量热,使反应温度过高,不利于反应进行;或浓硫酸会腐蚀设备等);
(3)根据上面的分析可知,Z可以是碳酸氢钠,故选c;
(4)步骤⑥分馏中,由于丙酮的沸点低于苯酚,则T为丙酮、P为苯酚,
故答案为:丙酮; 丙酮的沸点低;
(5)苯酚与浓溴水反应的化学方程式为 ,由于溴易挥发,所以第1加盐酸、第②步加KI溶液,要迅速盖好盖子,防止溴挥发,
,由于溴易挥发,所以第1加盐酸、第②步加KI溶液,要迅速盖好盖子,防止溴挥发,
故答案为: ;溴易挥发;
;溴易挥发;
(6)溶液中有淀粉,当达到滴定终点时,碘反应完全,所以滴定终点的现象是 由蓝色变为无色(或白色浑浊)且半分钟内不变色;
20mLKBrO3和KBr混合溶液[其中:c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L]置于锥形瓶中,再加入10mL6mol/L的盐酸,根据方程式BrO3-+5Br-+6H+→3Br2+3H2O可知,生成的溴的物质的量为3×0.0100mol/L×0.02L=6×10-4 mol,根据反应I2+2Na2S2O3→2NaI+Na2S4O6可知,由溴与碘化钾反应生成的碘的物质的量为0.0250mol/L×0.02248L×$\frac{1}{2}$=2.81×10-4 mol,所以与苯酚反应的溴的物质的量为6×10-4 mol-2.81×10-4 mol=3.19×10-4 mol,根据反应 可知,苯酚的物质的量为3.19×10-4 mol×$\frac{1}{3}$=1.06×10-4 mol,所以废水中苯酚的浓度是$\frac{1.06×1{0}^{-4}mol}{0.02L}$=0.0053mol/L,
可知,苯酚的物质的量为3.19×10-4 mol×$\frac{1}{3}$=1.06×10-4 mol,所以废水中苯酚的浓度是$\frac{1.06×1{0}^{-4}mol}{0.02L}$=0.0053mol/L,
故答案为:由蓝色变为无色(或白色浑浊)且半分钟内不变色;0.0053.
点评 本题考查有机物的制备实验方案,涉及对化学工艺流程、装置及试剂的分析评价等,关键是根据实验目的与给予的反应信息理解工艺流程原理,是对学生综合能力的考查,难度中等.

| A. | 2mol•L-1 | B. | 0.5mol•L-1 | C. | 1mol•L-1 | D. | 3mol•L-1 |
 右图是用点滴板探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板.下列对实验现象的解释正确的是( )
右图是用点滴板探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板.下列对实验现象的解释正确的是( )| 选项 | 实验现象 | 解释 |
| A | 红色石蕊试纸变蓝 | NH3极易溶于水 |
| B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
| C | 氯化铝溶液变浑浊 | NH3与AlCl3溶液反应:Al3++3OH-→Al(OH)3↓ |
| D | 浓盐酸附近有白烟 | NH3与挥发出的HCl反应:NH3+HCl→NH4Cl |
| A. | A | B. | B | C. | C | D. | D |
| A. | 维生素和淀粉遇碘水均显蓝色 | |
| B. | 蛋白质、乙酸和葡萄糖均属电解质 | |
| C. | 溴乙烷与NaOH乙醇溶液共热生成乙烯 | |
| D. | 乙酸乙酯和食用植物油均可水解生成乙醇 |
| A. | 反应后溶液可能呈中性 | |
| B. | 反应停止后一定有固体剩余 | |
| C. | 反应过程中一定有氧化还原反应发生 | |
| D. | 若只有Cu剩余,向溶液中滴入铁氰化钾溶液不会产生蓝色沉淀 |
| 实验装置 | 编号 | 溶液X | 实验现象 |
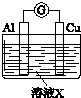 | 实验Ⅰ | 6mol•L-1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色. |
| 实验Ⅱ | 15mol•L-1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色. |
(2)实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是Al开始作电池的负极,Al在浓硝酸中迅速生成致密氧化膜后,Cu作负极.
查阅资料:活泼金属与1mol•L-1稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3-被还原.
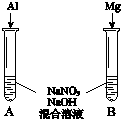 (3)用如图装置进行实验Ⅲ:溶液X为1mol•L-1稀硝酸溶液,观察到电流计指针向右偏转.
(3)用如图装置进行实验Ⅲ:溶液X为1mol•L-1稀硝酸溶液,观察到电流计指针向右偏转.①反应后的溶液中含NH4+.实验室检验NH4+的方法是取少量待检溶液于试管中,加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则溶液中含NH4+.
②生成NH4+的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(4)进一步探究碱性条件下NO3-的氧化性,进行实验Ⅳ:
①观察到A中有NH3生成,B中无明显现象.A、B产生不同现象的解释是Al与NaOH溶液反应产生H2的过程中可将NO3-还原为NH3,而Mg不能与NaOH.
②A中生成NH3的离子方程式是8Al+3NO3-+5OH-+2H2O=3NH3↑+8AlO2-.
(5)将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由因为铝与中性的硝酸钠溶液无生成H2的过程,NO3-无法被还原.

 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.