题目内容
3.写出下列物质的电离方程式:(1)NaClNaCl=Na++Cl-,
(2)H2SO4H2SO4=2H++SO42-.
分析 写物质的电离方程式,首先判断电解质的类型及电离出的阴阳离子,然后根据电解质的类型判断写可逆号还是等号,如果是多元弱酸,要分步电离,如果是多元弱碱,只需一步书写,最后要注意原子守恒、电荷守恒,氯化钠为强电解质完全电离出钠离子和氯离子,硫酸为二元强酸,一步完全电离出氢离子和硫酸根离子,据此即可解答.
解答 解:(1)氯化钠是强电解质,是由氯离子和钠离子构成,能完全电离,电离方程式为:NaCl=Na++Cl-,
故答案为:NaCl=Na++Cl-;
(2)硫酸是强电解质,一步电离出氢离子和硫酸根离子,即H2SO4═2H++SO42-,
故答案为:H2SO4=2H++SO42-.
点评 本题考查了电离方程式的书写,掌握电离方程式的书写方法并能灵活运用是正确解答此类题的关键,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
5.下列无色溶液能常量共存的离子组是( )
| A. | Ba2+、SO42-、Cl- | B. | K+、OH-、HCO3- | C. | Mg2+、SO42-、Cl- | D. | Cu2+、H+、Cl- |
14.下列化合物的命名中正确的是( )
| A. | CH2═CH-CH═CH21,3-二丁烯 | B. |  丁二醇 | ||
| C. |  甲基苯酚 | D. |  2-甲基丁烷 |
11.下列热化学方程式书写正确的是(△H的绝对值均正确)( )
| A. | 2H2O(g)═2H2(g)+O2(g)△H=-483.6 kJ•mol-1(△H代表反应热) | |
| B. | C(s)+O2(g)═CO2(g)△H=+393.5kJ/mol((△H代表反应热) | |
| C. | 2HNO3(aq)+Ba(OH)2(aq)═Ba(NO3)2(aq)+2H2O(l);△H=+114.6KJ/mol(△H代表反应热) | |
| D. | HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ/mol((△H代表中和热) |
18.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温下,28g CO中含有的分子数为NA | |
| B. | 1.0 mol•L-1 Na2SO4溶液中所含的Na+数为2NA | |
| C. | 标准状况下,22.4 L HCl气体中所含的原子数为NA | |
| D. | 1 mol N2所含有的原子数为NA |
8.有镁铝混合粉末10.2g,将它溶于500mL 4mol•L-1的盐酸中,当加入的氢氧化钠溶液1000mL时溶液中沉淀的质量最大,则氢氧化钠溶液的浓度的是( )
| A. | 2mol•L-1 | B. | 0.5mol•L-1 | C. | 1mol•L-1 | D. | 3mol•L-1 |
15.下列关于营养物质和高分子材料的说法中不正确的是( )
| A. | 油脂在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 | |
| C. | 用于食品包装的塑料制品,属于热塑性塑料,可回收再利用 | |
| D. | 聚氯乙烯塑料强度大,抗腐蚀性强,可以用来包装需长时间保存的食品 |
12. 右图是用点滴板探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板.下列对实验现象的解释正确的是( )
右图是用点滴板探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板.下列对实验现象的解释正确的是( )
 右图是用点滴板探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板.下列对实验现象的解释正确的是( )
右图是用点滴板探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板.下列对实验现象的解释正确的是( )| 选项 | 实验现象 | 解释 |
| A | 红色石蕊试纸变蓝 | NH3极易溶于水 |
| B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
| C | 氯化铝溶液变浑浊 | NH3与AlCl3溶液反应:Al3++3OH-→Al(OH)3↓ |
| D | 浓盐酸附近有白烟 | NH3与挥发出的HCl反应:NH3+HCl→NH4Cl |
| A. | A | B. | B | C. | C | D. | D |
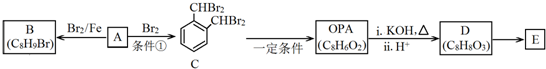
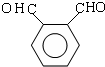 .
.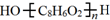 .D→E的化学方程式是n
.D→E的化学方程式是n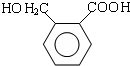 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$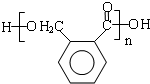 +(n-1)H2O(不必注反应条件).
+(n-1)H2O(不必注反应条件).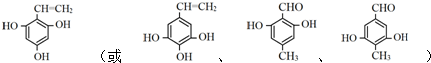 (写1种即可).
(写1种即可).