题目内容
16.回答下列问题:(1)纯碱溶液中滴入酚酞溶液,观察到的现象是溶液变红;原因是CO32-+H2O?HCO3-+OH-.(用离子方程式说明)
(2)把AlCl3溶液蒸干灼烧,最后得到的主要固体产物是Al2O3,为什么?(用化学方程式和必要的文字说明)因为AlCl3是挥发性酸所形成的铝盐,加热促进AlCl3水解,以致完全得到Al(OH)3,HCl则挥发掉:AlCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3↓+3HCl↑,高温下,可使Al(OH)3分解,2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,固体产物为Al2O3.
分析 (1)纯碱为强碱弱酸盐,CO32-水解呈碱性,水解离子方程式为CO32-+H2O?HCO3-+OH-;
(2)根据AlCl3属于强酸弱碱盐,在溶液中存在水解平衡,从平衡移动的角度分析并解答该题;
解答 解:(1)纯碱为强碱弱酸盐,CO32-水解呈碱性,水解离子方程式为CO32-+H2O?HCO3-+OH-,加入酚酞溶液变红色,
故答案为:溶液变红;CO32-+H2O?HCO3-+OH-;
(2)氯化铝为强酸弱碱盐,Al3+发生水解,水解的方程式为Al3++3H2O?Al(OH)3+3H+,水解后溶液呈酸性,蒸干和灼烧过程中,HCl挥发,Al(OH)3不稳定,灼烧时分解生成Al2O3,
故答案为:Al2O3,因为AlCl3是挥发性酸所形成的铝盐,加热促进AlCl3水解,以致完全得到Al(OH)3,HCl则挥发掉:AlCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3↓+3HCl↑,高温下,可使Al(OH)3分解,2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,固体产物为Al2O3.
点评 本题是基础性试题的考查,试题难易适中,基础性强.该题的关键是明确盐类水解的原理,然后结合提高信息灵活运用即可.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
11.油漆工业的原料之一Fe2O3可由FeSO4加热分解制得,请写出该反应的化学方程式2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO2↑+SO3↑..
1.某品牌茶叶中铁元素的检验可经过以下四个步骤完成:将茶叶灼烧灰化→用浓硝酸溶解茶叶灰→过滤得到的滤液→检验滤液中的Fe3+.图是该实验可能用到的实验用品.有关该实验的说法中错误的是( )


| A. | 第一步需选用仪器①、②和⑨,仪器①的名称叫坩埚 | |
| B. | 第二步用浓硝酸溶解茶叶灰,可能将Fe2+氧化成Fe3+ | |
| C. | 要完成第三步,需选用④、⑤和⑦,除夹持仪器外还缺滤纸 | |
| D. | 第四步,用试剂⑧检验滤液中的Fe3+,溶液中生成血红色沉淀 |
8.铁、铜单质及其化合物应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl2•2H2O),为制取纯净的CuCl2•2H2O,首先将其制成酸性水溶液,然后按如图步骤进行提纯:
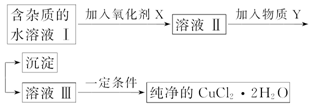
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表:
请回答下列问题:
(1)加入氧化剂的目的是将Fe2+氧化为Fe3+,Fe3+便于生成沉淀与Cu2+分离.
(2)最适合作氧化剂X的是C,写出该反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y可以是C.A.NaOH溶液 B.氨水 C.CuO D.Cu
(4)最后能不能直接蒸发结晶得到CuCl2•2H2O晶体?不能(填“能”或“不能”).若能,不用回答;若不能,回答该如何操作?应在HCl氛围中加热蒸发.

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
(1)加入氧化剂的目的是将Fe2+氧化为Fe3+,Fe3+便于生成沉淀与Cu2+分离.
(2)最适合作氧化剂X的是C,写出该反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y可以是C.A.NaOH溶液 B.氨水 C.CuO D.Cu
(4)最后能不能直接蒸发结晶得到CuCl2•2H2O晶体?不能(填“能”或“不能”).若能,不用回答;若不能,回答该如何操作?应在HCl氛围中加热蒸发.
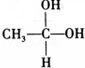 →CH3-CHO+H2O
→CH3-CHO+H2O
 .
.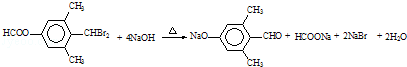 .
.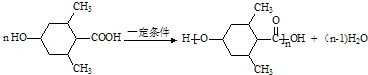 .
.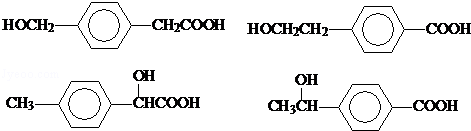 .
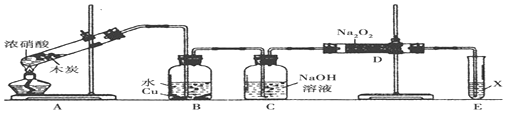
.
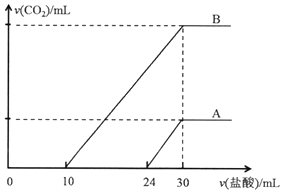 向两份30ml同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N.若向M、N溶液中逐滴加入浓度为0.25mol•L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B.
向两份30ml同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N.若向M、N溶液中逐滴加入浓度为0.25mol•L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B.