题目内容
18.现欲配制Cl橛度为0.50mol/L的MgCl2溶液100mL,回答下列问题:(1)需称量MgCl2固体4.8g
(2)所需的玻璃仪器有烧杯、玻璃棒100mL容量瓶、胶头滴管;具体说明玻璃棒在本实验中的用途搅拌、引流
(3)以下操作使所配溶液浓度降低的是ab
a.将烧杯中已溶解的溶液转移后,即加水至刻度线
b.称量的MgCl2固体中含NaCl杂质
c.正确定容摇匀后却发现液面下降.
分析 (1)依据m=CVM计算需要溶质的质量;
(2)依据配制一定物质的量浓度溶液一般步骤选择需要仪器,依据溶解、移液操作过程判断玻璃棒作用;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制物质的量浓度为0.50mol/L的MgCl2溶液100mL,需要溶质氯化镁质量m=0.50mol/L×0.1L×95g/mol=4.8g;
故答案为:4.8g;
(2)用固体配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,用到的仪器:托盘天平、药匙、烧杯、量筒、玻璃棒、容量瓶、胶头滴管,用到的玻璃仪器除了烧杯、玻璃棒还有100mL容量瓶、胶头滴管;溶解过程中为了加快固体溶解速率,需要用玻璃棒搅拌,移液操作中需要用玻璃棒进行引流;
故答案为:100mL容量瓶、胶头滴管;搅拌、引流;
(3)a.将烧杯中已溶解的溶液转移后,即加水至刻度线,为进行洗涤操作,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故a选;
b.称量的MgCl2固体中含NaCl杂质,导致称取的固体中含有溶质的物质的量偏小,溶液浓度偏低,故b选;
c.正确定容摇匀后却发现液面下降,属于正常操作,溶质的物质的量和溶液体积都不产生影响,溶液不变,故c不选;
故选:ab.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,明确配制原理及操作步骤是解题关键,注意误差分析的方法,题目难度不大.

练习册系列答案
相关题目
8.铁、铜单质及其化合物应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl2•2H2O),为制取纯净的CuCl2•2H2O,首先将其制成酸性水溶液,然后按如图步骤进行提纯:
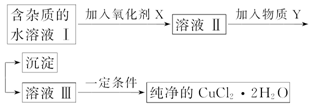
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表:
请回答下列问题:
(1)加入氧化剂的目的是将Fe2+氧化为Fe3+,Fe3+便于生成沉淀与Cu2+分离.
(2)最适合作氧化剂X的是C,写出该反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y可以是C.A.NaOH溶液 B.氨水 C.CuO D.Cu
(4)最后能不能直接蒸发结晶得到CuCl2•2H2O晶体?不能(填“能”或“不能”).若能,不用回答;若不能,回答该如何操作?应在HCl氛围中加热蒸发.

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
(1)加入氧化剂的目的是将Fe2+氧化为Fe3+,Fe3+便于生成沉淀与Cu2+分离.
(2)最适合作氧化剂X的是C,写出该反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y可以是C.A.NaOH溶液 B.氨水 C.CuO D.Cu
(4)最后能不能直接蒸发结晶得到CuCl2•2H2O晶体?不能(填“能”或“不能”).若能,不用回答;若不能,回答该如何操作?应在HCl氛围中加热蒸发.
9.海水晒盐的原理是( )
| A. | 海水分解 | |
| B. | 温度升高,其他溶质的溶解度增大 | |
| C. | 升高温度,降低食盐在水中的溶解度 | |
| D. | 利用阳光、风力蒸发水分使氯化钠成晶体析出 |
10.下列气体不能用排空气法收集的是( )
| A. | H2 | B. | Cl2 | C. | NO | D. | NO2 |
7.用NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 9g超重水(3H216O)含中子数为6NA | |
| B. | 标准状况下,22.4LCCl4含有的分子数目为NA | |
| C. | 常温常压下,16g甲烷含有共价键数目为4NA | |
| D. | 1L0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
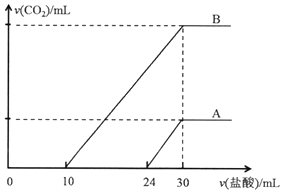 向两份30ml同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N.若向M、N溶液中逐滴加入浓度为0.25mol•L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B.
向两份30ml同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N.若向M、N溶液中逐滴加入浓度为0.25mol•L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B.