题目内容
短周期元素X、Y、Z原子序数之和为36,X2-与Y+具有相同的核外电子层结构,Y、Z位于同一周期.下列推测不正确的是( )
| A、原子半径Z>Y |
| B、同周期元素中Y的金属性最强 |
| C、同主族元素中X的氢化物稳定性最高 |
| D、同周期元素中Z的最高价氧化物的水化物酸性最强 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y在同一周期,X2-与Y+具有相同的核外电子层结构,可推X在Z、Y的上一个周期,又因为X、Y、Z原子序数之和为36,平均原子序数为12,则X为O、Y为Na、进而可知Z为Cl,结合元素周期律的递变规律解答该题.
解答:
解:X、Y在同一周期,X2-与Y+具有相同的核外电子层结构,可推X在Z、Y的上一个周期,又因为X、Y、Z原子序数之和为36,平均原子序数为12,则X为O、Y为Na、进而可知Z为Cl,则
A.Z为Cl,Y为Na,同周期元素从左到右元素的原子半径逐渐减小,故A错误;
B.Y为Na,由同周期元素从左到右元素的金属性逐渐减弱可知同周期元素中Y的金属性最强,故B正确;
C.X的氢化物为H2O,X位于同族的最上方,根据元素周期律,同族元素中Z的氢化物稳定性最高,故C正确;
D.Z为Cl,同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物的水化物的酸性逐渐增强,故D正确.
故选A.
A.Z为Cl,Y为Na,同周期元素从左到右元素的原子半径逐渐减小,故A错误;
B.Y为Na,由同周期元素从左到右元素的金属性逐渐减弱可知同周期元素中Y的金属性最强,故B正确;
C.X的氢化物为H2O,X位于同族的最上方,根据元素周期律,同族元素中Z的氢化物稳定性最高,故C正确;
D.Z为Cl,同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物的水化物的酸性逐渐增强,故D正确.
故选A.
点评:本题考查元素的推断和元素周期律,题目难度中等,注意把握元素的推断的角度以及元素周期律的递变规律.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
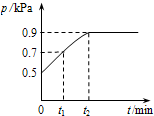 在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )A、从反应开始到t1时的平均反应速率v(X)=
| ||
| B、该温度下此反应的平衡常数K=0.32 | ||
| C、欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | ||
| D、其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
如图所示的实验操作中正确的是( )
A、 制取氧气 |
B、 检查装置气密性 |
C、 加入药品 |
D、 除去CO中的CO2 |
工业制硫酸的第一步反应,可用化学方程式表示如下:4FeS2+11O2=2Fe2O3+8SO2对此反应下列说法中正确的是( )
| A、FeS2既是氧化剂又是还原剂 |
| B、O2只做氧化剂 |
| C、氧化产物只有Fe2O3 |
| D、4mol FeS2发生反应时,反应中共有22mol电子转移 |
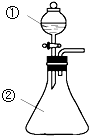 在实验室中,用如图所示装置(尾气处理装置略去)进行下列实验,将①中液体逐滴滴入到②中.实验结果与预测的现象一致的是 ( )
在实验室中,用如图所示装置(尾气处理装置略去)进行下列实验,将①中液体逐滴滴入到②中.实验结果与预测的现象一致的是 ( ) 
 为碳原子,
为碳原子, 为硅原子).每个碳原子周围与其距离最近的硅原子有
为硅原子).每个碳原子周围与其距离最近的硅原子有