题目内容
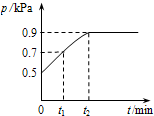 在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )A、从反应开始到t1时的平均反应速率v(X)=
| ||
| B、该温度下此反应的平衡常数K=0.32 | ||
| C、欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | ||
| D、其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
考点:化学平衡建立的过程
专题:化学平衡专题
分析:A、在恒容容器中,气体的压强之比等于物质的量之比,利用三段式法计算P为0.7KPa时,反应掉X的物质的量求算;
B、在恒容容器中,气体的压强之比等于物质的量之比,利用三段式法计算平衡状态时即P为0.9KPa时各物质的浓度,求算K;
C、升温平衡逆向移动;
D、恒容容器中,平衡时再充入X,平衡正向移动,但正反应为气体体积增大的反应,X转化率降低.
B、在恒容容器中,气体的压强之比等于物质的量之比,利用三段式法计算平衡状态时即P为0.9KPa时各物质的浓度,求算K;
C、升温平衡逆向移动;
D、恒容容器中,平衡时再充入X,平衡正向移动,但正反应为气体体积增大的反应,X转化率降低.
解答:
解:A、设反应的X物质的量为x,
X(g)?Y(g)+Z(g)
起始量(mol) 0.10 0 0
转化量(mol) x x x
0.7KPa量(mol)0.10-x x x
在恒容容器中,气体的压强之比等于物质的量之比,有
=
,x=0.04,所以v(X)=
mol/(L?s)=
mol/(L?s),故A错误;
B、设反应的X物质的量为x,
X(g)?Y(g)+Z(g)
起始量(mol) 0.10 0 0
转化量(mol) x x x
平衡量(mol)0.10-x x x
在恒容容器中,气体的压强之比等于物质的量之比,有
=
,x=0.08,容器体积为1.0L,所以K=
=0.32,故B正确;
C、升温平衡逆向移动,Y含量减小,故C错误;
D、恒容容器中,平衡时再充入X,平衡正向移动,但正反应为气体体积增大的反应,X转化率降低,故D错误;
故选B.
X(g)?Y(g)+Z(g)
起始量(mol) 0.10 0 0
转化量(mol) x x x
0.7KPa量(mol)0.10-x x x
在恒容容器中,气体的压强之比等于物质的量之比,有
| 0.10-x+x+x |
| 0.10 |
| 0.7 |
| 0.5 |
| ||
| t1 |
| 0.04 |
| t1 |
B、设反应的X物质的量为x,
X(g)?Y(g)+Z(g)
起始量(mol) 0.10 0 0
转化量(mol) x x x
平衡量(mol)0.10-x x x
在恒容容器中,气体的压强之比等于物质的量之比,有
| 0.10-x+x+x |
| 0.10 |
| 0.9 |
| 0.5 |
| 0.08×0.08 |
| 0.10-0.08 |
C、升温平衡逆向移动,Y含量减小,故C错误;
D、恒容容器中,平衡时再充入X,平衡正向移动,但正反应为气体体积增大的反应,X转化率降低,故D错误;
故选B.
点评:本题考查了三段式法在平衡计算中的应用以及化学平衡的移动,题目难度中等.

练习册系列答案
相关题目
下列关于氧化还原反应与四种基本反应类型的关系说法正确的是( )
| A、化合反应都不是氧化还原反应 |
| B、有单质生成的分解反应一定是氧化还原反应 |
| C、有一些置换反应不是氧化还原反应 |
| D、有氧元素参与的复分解反应是氧化还原反应 |
某气体由常见的一种或多种气体组成,经测定其中只含有碳、氧两种元素,碳、氧元素的质量比为3:8,则关于该气体的说法正确的是( )
| A、该气体一定是纯净物 |
| B、该气体一定是CO、CO2的混合物 |
| C、该气体中所含的物质最多只有2种 |
| D、该气体的组成情况可能有3种组合 |
分子式为C6H10的有机物其结构不可能是( )
| A、含有一个双键的直链有机物 |
| B、含有两个双键的直链有机物 |
| C、含有一个双键的环状有机物 |
| D、含有两个环的环状有机物 |
短周期元素X、Y、Z原子序数之和为36,X2-与Y+具有相同的核外电子层结构,Y、Z位于同一周期.下列推测不正确的是( )
| A、原子半径Z>Y |
| B、同周期元素中Y的金属性最强 |
| C、同主族元素中X的氢化物稳定性最高 |
| D、同周期元素中Z的最高价氧化物的水化物酸性最强 |
下列关于物质分类的说法正确的是( )
| A、油脂、糖类、蛋白质均是天然高分子化合物 |
| B、三氯甲烷、氯乙烯、三溴苯酚均是卤代烃 |
| C、CaCl2、烧碱、聚苯乙烯均为化合物 |
| D、稀豆浆、硅酸、雾霾均为胶体 |

 已知短周期主族元素A、B、C、D、E的原子序数依次增大,A、C、D原子的最外层电子数之和为12,C、D、E位于同一周期,B、D同主族.D原子的最外层电子数既是A原子内层电子数的3倍又是C原子最外层电子数的3倍.请回答下列问题:
已知短周期主族元素A、B、C、D、E的原子序数依次增大,A、C、D原子的最外层电子数之和为12,C、D、E位于同一周期,B、D同主族.D原子的最外层电子数既是A原子内层电子数的3倍又是C原子最外层电子数的3倍.请回答下列问题: