题目内容
已知X、Y、Z、T四种元素中,只有T不是短周期元素,与它们有关的部分信息如表:
(1)Y元素在周期表中的位置为第 周期 族,写出X的基态原子核外电子排布式:
(2)工业冶炼T元素单质的主要反应中,还原剂是 ,T元素的单质冶炼方法与Y元素的单质冶炼方法不同,其原因是 .
(3)对Z元素的单质或化合物描述一定正确的是
a.单质不溶于任何溶剂 b.其最高价氧化物的水化物为弱酸
c.其最高价氧化物的晶体为分子晶体 d.气态氢化物稳定性小于X的气态氢化物的稳定性
(4)上述四种元素中,最高价氧化物的水化物呈两性的物质是 (填化学式),试用电离方程式表示其呈两性的原因: .
| 元素编号 | 元素性质或原子结构 |
| X | 其氧化物是汽车尾气的主要有害成分之一,也是空气质量预报的指标之一;该元素第一电离能比其同周期的后一种元素高 |
| Y | 在地壳中的含量居于第三位,单质通常由电解法制取 |
| Z | 原子核外有五种不同能量的电子,且最外层有2个未成对电子 |
| T | 其合金在生产和生活中用量最大,原子核外有4个电子层,在化学反应中可以失去最外层的2个电子和次外层的1个电子 |
(2)工业冶炼T元素单质的主要反应中,还原剂是
(3)对Z元素的单质或化合物描述一定正确的是
a.单质不溶于任何溶剂 b.其最高价氧化物的水化物为弱酸
c.其最高价氧化物的晶体为分子晶体 d.气态氢化物稳定性小于X的气态氢化物的稳定性
(4)上述四种元素中,最高价氧化物的水化物呈两性的物质是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:汽车尾气主要成分是氮氧化物,能造成大气污染,其氧化物是汽车尾气的主要有害成分之一,也是空气质量预报的指标之一;N元素由于其P轨道处于半充满状态,故其第一电离能比其同周期的后一种元素O的高,故X为N;
在地壳中的含量居于第三位的元素是Al,Al单质通常由电解氧化铝的方法制取,故Y是Al;
Z原子核外有五种不同能量的电子,且最外层有2个未成对电子,故Z的核外电子排布为:1s22s22p63s23p2或者1s22s22p63s23p4,故Z是Si或者S;
T的合金在生产和生活中用量最大,原子核外有4个电子层,在化学反应中可以失去最外层的2个电子和次外层的1个电子,故T是Fe,据此分别解答各小题即可.
在地壳中的含量居于第三位的元素是Al,Al单质通常由电解氧化铝的方法制取,故Y是Al;
Z原子核外有五种不同能量的电子,且最外层有2个未成对电子,故Z的核外电子排布为:1s22s22p63s23p2或者1s22s22p63s23p4,故Z是Si或者S;
T的合金在生产和生活中用量最大,原子核外有4个电子层,在化学反应中可以失去最外层的2个电子和次外层的1个电子,故T是Fe,据此分别解答各小题即可.
解答:
解:(1)依据分析可知Y为Al,处于第三周期第ⅢA族,X为N,其基态电子排布为:1s22s22p3,故答案为:三,ⅢA; 1s22s22p3;
(2)工业冶炼Fe元素的主要反应中,还原剂是CO,由于Al比Fe活泼,故Al利用电解氧化铝制取,故答案为:CO; 金属性强弱不同;
(3)Z是Si或者S,
a.S不溶于水,但是能溶于二硫化碳,故不溶于任何溶剂,故错误;
b.S的最高价氧化物的水化物硫酸为强酸,故错误;
c.Si的最高价氧化物的晶体为原子晶体,故错误;
d.X为Cl,故S或者Si的气态氢化物稳定性均小于Cl的气态氢化物的稳定性,故正确,
故答案为:d;
(4)依据分析得知最高价氧化物的水化物呈两性的物质是:Al(OH)3,它呈现两性的原因是:AlO2-+H++H2O?Al(OH)3?Al3++3OH-,
故答案为:Al(OH)3; AlO2-+H++H2O?Al(OH)3?Al3++3OH-.
(2)工业冶炼Fe元素的主要反应中,还原剂是CO,由于Al比Fe活泼,故Al利用电解氧化铝制取,故答案为:CO; 金属性强弱不同;
(3)Z是Si或者S,
a.S不溶于水,但是能溶于二硫化碳,故不溶于任何溶剂,故错误;
b.S的最高价氧化物的水化物硫酸为强酸,故错误;
c.Si的最高价氧化物的晶体为原子晶体,故错误;
d.X为Cl,故S或者Si的气态氢化物稳定性均小于Cl的气态氢化物的稳定性,故正确,
故答案为:d;
(4)依据分析得知最高价氧化物的水化物呈两性的物质是:Al(OH)3,它呈现两性的原因是:AlO2-+H++H2O?Al(OH)3?Al3++3OH-,
故答案为:Al(OH)3; AlO2-+H++H2O?Al(OH)3?Al3++3OH-.
点评:本题主要考查的是元素的推断以及元素化合物的知识,综合性较强,属于常考题目类型,注意总结.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2012年2月6日,在辽宁沈阳至本溪段的丹霞公路发生了应雾大路滑而引起汽车追尾的重大的交通事故.雾属于下列哪种分散系( )
| A、乳浊液 | B、溶液 |
| C、胶体 | D、悬浊液 |
分子式为C6H10的有机物其结构不可能是( )
| A、含有一个双键的直链有机物 |
| B、含有两个双键的直链有机物 |
| C、含有一个双键的环状有机物 |
| D、含有两个环的环状有机物 |
短周期元素X、Y、Z原子序数之和为36,X2-与Y+具有相同的核外电子层结构,Y、Z位于同一周期.下列推测不正确的是( )
| A、原子半径Z>Y |
| B、同周期元素中Y的金属性最强 |
| C、同主族元素中X的氢化物稳定性最高 |
| D、同周期元素中Z的最高价氧化物的水化物酸性最强 |
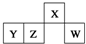 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A、原子半径:rW>rZ>rY>rX |
| B、含Y元素的硫酸盐溶液可以和强酸、强碱反应 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X与氢元素组成的化合物XH5与水反应可产生两种气体 |
氯气溶于水达到平衡后,下列叙述中正确的是( )
| A、通入少量SO2,溶液的漂白性增强 | ||
| B、加入少量Na2CO3粉末或CaCO3粉末,c(H+)减小,HClO浓度增大 | ||
| C、加入少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-) | ||
D、再加入少量水,
|
可逆反应aA(g)+bB(s)?cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )


| A、升高温度,平衡向逆反应方向移动 |
| B、使用催化剂,C的物质的量分数增加 |
| C、化学方程式系数a<c+d |
| D、根据图象无法确定改变温度后平衡移动方向 |
已知甲醇的燃烧热数值为726.51kJ?mol-1.下列热化学方程式书写正确的是( )
A、CH4O+
| ||
B、CH4O(l)+
| ||
| C、2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1453.12 kJ?mol-1 | ||
D、CH4O(l)+
|