题目内容
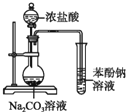
5.如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).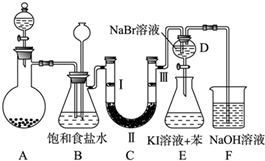
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.装置B中饱和食盐水的作用是除去Cl2中混有的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中有水柱上升.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
(5)如果将过量二氧化锰与20mL 12mol•L-1的浓盐酸混合加热,充分反应后生成的氯气小于0.06mol.(填“大于”“小于”“等于”),若有17.4g的MnO2被还原,则被氧化的HCl的质量为14.6g.
分析 (1)二氧化锰与浓盐酸反应生成氯化锰、氯气和水;制取的氯气中含有氯化氢杂质,依据氯气和氯化氢气体的性质选择合适的除杂剂,结合装置中气体压强变化分析现象;
(2)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(3)氯气的氧化性强于溴,溴的氧化性强于碘,据此解答;
(4)氯气有毒,直接排放容易造成空气污染,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以被氢氧化钠吸收;
(5)过量二氧化锰与盐酸反应,随反应进行浓盐酸变为稀盐酸不再生成氯气;根据二氧化锰和作还原剂的HCl之间的关系式计算.
解答 解:(1)二氧化锰与浓盐酸反应生成氯化锰、氯气和水,方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;制取的氯气中含有氯化氢杂质,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,选择饱和食盐水吸收氯气中的氯化氢,装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大,B中长颈漏斗中液面上升,形成水柱;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O; 除去Cl2中混有的HCl;B中长颈漏斗中有水柱上升;
(2)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选d;
故答案为:d;
(3)D中是溴化钠,当向D中缓缓通入少量氯气时,氯气和溴化钠反应生成溴单质,可以看到无色溶液逐渐变为黄,所以现象为:溶液从无色变化为橙色;
溴单质的氧化性强于碘单质,溴单质和碘化钾反应生成碘单质,碘单质溶于苯呈紫红色,振荡.观察到的现象是:E中溶液分为两层,上层(苯层)为紫红色;
故答案为:黄(橙黄、橙色、橙红等); E中溶液分为两层,上层液体显紫红色;
(4)氯气有毒,直接排放容易造成空气污染,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以被氢氧化钠吸收,反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)如果将过量的二氧化锰与20mL、12 mol•L-1的盐酸混合加热,随反应进行浓盐酸变为稀盐酸不再生成氯气,充分反应生成氯气的物质的量小于0.06mol;17.4gMnO2的物质的量=$\frac{17.4g}{87g/mol}$=0.2mol,反应中二氧化锰和被氧化的HCl的物质的量之比为1:2,有0.2mol二氧化锰参加反应,则有0.4molHCl被氧化,质量为0.4mol×36.5g/mol=14.6g;
故答案为:小于;14.6g.
点评 本题考查性质实验方案的制备,为高频考点,把握氯气的性质、制法、装置的作用及氧化还原反应原理为解答的关键,注意同主族元素性质的递变规律,题目难度中等.

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案| A. | 泡沫灭火器中将Al2(SO4)3与NaHCO3两溶液混合后,喷出大量泡沫,起到灭火作用 | |
| B. | KNO3、KClO3与单质S、C2H5OH混搭存放在同一库房间 | |
| C. | 包装用材料聚乙烯、聚氯乙烯等都属于烃 | |
| D. | 绿色化学的核心就是治理工业生产对环境产生的污染 |
| A. | O2和O3 | B. | CH3CH3和CH3CH2CH2CH3 | ||
| C. | H和D | D. | 正丁烷和异丁烷 |
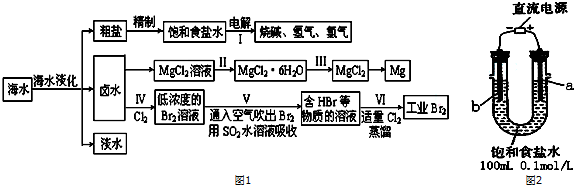
(一)某化学研究小组用图2装置模拟步骤I电解食盐水(用铁和石墨做电极).
(1)a电极材料是石墨(填铁、石墨),其电极反应式为2Cl--2e-=Cl2↑.
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为12(忽略反应前后溶液体积的变化).
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+.下表是生成氢氧化物沉淀的pH:
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
| 完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2•H2O获得MgCl2的操作是:将MgCl2•6H2O在干燥的HCl气流中加热.
(三)制取工业溴:
(5)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是富集溴元素.
(6)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式:Br2+SO2+2H2O=4H++SO42-+2Br-.
| A. | 元素种类 | B. | 原子数目 | C. | 化学键 | D. | 原子核 |
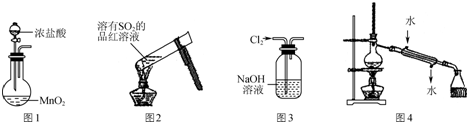
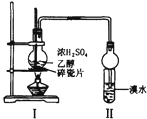
| A. | 实验室用图1装置制备Cl2 | |
| B. | 加热后图2中溶液颜色恢复红色 | |
| C. | 用图3装置除去Cl2中含有的少量HCl | |
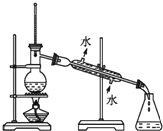
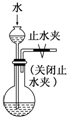
| D. | 实验室用图4装置制取少量蒸馏水 |
| A. | N2的电子式: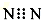 | B. | H2O2的电子式 | ||
| C. | 氨分子的结构式 | D. | 14C的原子结构示意图 |
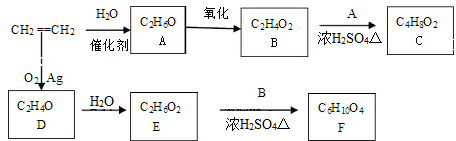
 CH3COOC2H5+H2O,该反应的类型为酯化反应(或取代反应);
CH3COOC2H5+H2O,该反应的类型为酯化反应(或取代反应);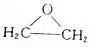 ,写出D和H2O反应生成E的化学方程式
,写出D和H2O反应生成E的化学方程式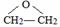 +H2O$\stackrel{一定条件}{→}$HOCH2CH2OH;
+H2O$\stackrel{一定条件}{→}$HOCH2CH2OH; ;
;