题目内容
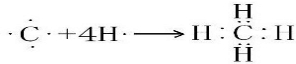
13.下列化学用语正确的是( )| A. | N2的电子式: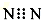 | B. | H2O2的电子式 | ||
| C. | 氨分子的结构式 | D. | 14C的原子结构示意图 |
分析 A.N原子满足8电子稳定结构,漏写N上的孤对电子;
B.H2O2为共价化合物,不含离子;
C.氨分子中只存在N-H共价键,为三角锥型;
D.C的质子数为6.
解答 解:A.N原子满足8电子稳定结构,漏写N上的孤对电子,则电子式为 ,故A错误;
,故A错误;
B.H2O2为共价化合物,不含离子,分子中存在两个氧氢键和一个O-O键,其电子式为 ,故B错误;
,故B错误;
C.氨分子中只存在N-H共价键,为三角锥型,NH3的电子式为 ,结构式为
,结构式为 ,故C正确;
,故C正确;
D.C的质子数为6,14C的原子结构示意图为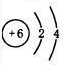 ,故D错误;
,故D错误;
故选C.
点评 本题考查化学用语,涉及电子式、结构式及原子结构示意图等,为高频考点,把握化学用语的区别及规范使用为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
5.如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
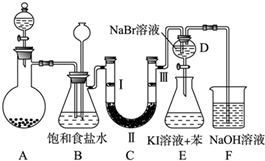
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.装置B中饱和食盐水的作用是除去Cl2中混有的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中有水柱上升.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为黄(橙黄、橙色、橙红等)色,打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
(5)如果将过量二氧化锰与20mL 12mol•L-1的浓盐酸混合加热,充分反应后生成的氯气小于0.06mol.(填“大于”“小于”“等于”),若有17.4g的MnO2被还原,则被氧化的HCl的质量为14.6g.

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.装置B中饱和食盐水的作用是除去Cl2中混有的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中有水柱上升.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
(5)如果将过量二氧化锰与20mL 12mol•L-1的浓盐酸混合加热,充分反应后生成的氯气小于0.06mol.(填“大于”“小于”“等于”),若有17.4g的MnO2被还原,则被氧化的HCl的质量为14.6g.
4.A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由大到小的顺序是( )
| A. | A、B、C、D、E | B. | E、C、D、A、B | C. | B、A、D、C、E | D. | C、D、E、B、A |
1.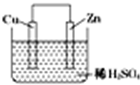 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是 ①①Cu为负极( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是 ①①Cu为负极( )
②SO42-向正极移动
③电子是由Zn经外电路流向Cu
④Zn极上有H2产生
⑤若有1mol电子流经导线,则可产生的H2为0.5mol
⑥负极的电极反应式为Zn-2e-=Zn2+.
 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是 ①①Cu为负极( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是 ①①Cu为负极( ) ②SO42-向正极移动
③电子是由Zn经外电路流向Cu
④Zn极上有H2产生
⑤若有1mol电子流经导线,则可产生的H2为0.5mol
⑥负极的电极反应式为Zn-2e-=Zn2+.
| A. | ①②③ | B. | ③④⑤ | C. | ③⑤⑥ | D. | ②③⑥ |
8.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 铍的氧化物对应的水化物具有两性 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,钠的燃烧产物比铷(Rb)的燃烧产物更复杂 | |
| D. | 硫酸锶(SrSO4)是难溶于水的白色固体 |
18.若周期表ⅢA族中的某元素X和ⅥA族中的某元素Y化合,下列说法中肯定不可能的是( )
| A. | 形成了X3+离子和Y2-离子 | B. | 形成的化合物中含有离子键 | ||
| C. | 形成分子式为X3Y2的化合物 | D. | 形成的化合物可能具有两性 |
2.化学与生活、社会密切相关.下列说法正确的是( )
| A. | Si常用做信息高速公路的骨架--光导纤维的主要材料 | |
| B. | 测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热 | |
| C. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 | |
| D. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 |
3.下列叙述中不正确的是( )
| A. | 卤化氢分子中,卤素的非金属性越强,共价键的极性也越强,稳定性也越强 | |
| B. | 以极性键结合的分子,不一定是极性分子 | |
| C. | 判断A2B或AB2型分子为极性分子必须知道该分子的空间构型 | |
| D. | 非极性分子中,各原子间都应以非极性键结合 |
 .
.