题目内容
18. 元素周期表的用途广泛.
元素周期表的用途广泛.(1)用“>”或“<”填空:
| 离子半径 | 非金属性 | 酸性 | 沸点 |
| K+<S2- | N<O | 硫酸<高氯酸 | HF>HCl |
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液$→_{Ⅰ}^{80℃,通电}$NaClO3溶液$→_{Ⅱ}^{室温,KCl}$KClO3晶体
①完成Ⅰ中反应的总化学方程式:□NaCl+□H2O═□NaClO3+□3H2↑.
②Ⅱ中转化的基本反应类型是复分解反应,该反应过程能析出KClO3晶体而无其它晶体析出的原因是室温下KClO3在水中的溶解度明显小于其它晶体.
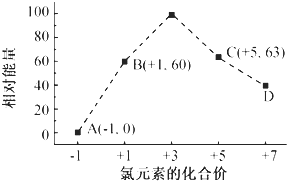
(4)一定条件,在水溶液中1mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示.
①D是ClO4-(填离子符号).
②B→A+C反应的热化学方程式为3ClO-(aq)═(aq)+2Cl-(aq)△H=-117kJ/mol(用离子符号表示)
分析 (1)电子层排布相同,核电荷数越大离子半径越小;
同一周期自左而右,非金属性增强;
元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
HF中含氢键,沸点最高,HBr、HCl中相对分子质量大的沸点高;
(2)非金属性单质氧化性越强,元素非金属性越强,氢化物稳定性、最高价含氧酸的酸性、单质与氢气反应难易程度、元素化合时化合价等可以判断元素非金属性强弱,熔点属于物理性质,不能比较元素非金属性强弱,氢化物酸性也不能比较非金属性强弱;
(3)①电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气;
②两种化合物相互交换成分生成另外的两种化合物的反应为复分解反应,相同温度下,溶解度小的物质先析出;
(4)①D微粒中Cl元素化合价为+7,结合离子所带电荷等于各元素化合价之和计算;
②B→A+C发生反应:3ClO-=ClO3-+2Cl-,反应热△H=生成物总能量-反应物总能量,注意离子为溶液状态,进而书写热化学方程式;
解答 解:(1)K+与S2-电子层排布相同,核电荷数越大离子半径越小,所以离子半径:K+<S2-;
同一周期自左而右,非金属性增强,所以非金属性:N<O;
元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,氯元素的非金属性比硫元素强,所以酸性:HClO4>H2SO4;
可说明HF中含氢键,沸点最高,则沸点:HF>HCl;
故答案为:<;<;<;>;
(2)a.单质的熔点属于物理性质,不能比较非金属性强弱,故a错误;
b.Cl2、Br2、I2的氧化性越强,元素的非金属性越强,故b正确;
c.氢化物越稳定,元素的非金属性越强,故c正确;
d.氢化物的酸性不能比较非金属性强弱,如HF属于弱酸、HCl属于强酸,为F元素非金属性强于Cl的,故d错误,
故选:bc;
(3)①电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气,所以反应方程式为1NaCl+3H2O═1NaClO3+3H2↑,
故答案为:1;3;1;3;3H2↑;
②NaClO3转化为KClO3,说明该反应中两种物质相互交换离子生成盐,为复分解反应,相同温度下,溶解度小的物质先析出,室温下KClO3在水中的溶解度明显小于其它晶体,所以先析出KClO3;
故答案为:复分解反应;室温下KClO3在水中的溶解度明显小于其它晶体;
(4)①根据图象知,D中Cl元素化合价为+7价,所以ClOx-中x为4,则D为ClO4-;
故答案为:ClO4-;
②B→A+C发生反应:3 ClO-=ClO3-+2Cl-,根据离子能量可知,反应热△H=53kJ/mol+2×0kJ/mol-3×60kJ/mol=-117kJ/mol,故反应热化学方程式为:3ClO-(aq)═ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol,
故答案为:3ClO-(aq)═ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol;
点评 本题以卤族元素为载体考查了氧化还原反应、热化学反应、非金属强弱的判断方法等知识点,根据物质的性质、原子结构结合元素周期律等知识点来分析解答,题目难度中等.

| A. | 氧化剂与还原剂的物质的量之比为1:6 | |
| B. | 氧化产物与还原产物的质量之比为1:1 | |
| C. | 生成3mol水时有1mol KIO3被氧化 | |
| D. | 1mol KIO3参加反应时有5mol电子转移 |
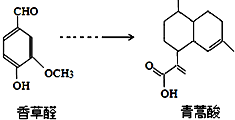
下列叙述正确的是( )
| A. | 青蒿酸分子中含有4个手性碳原子 | |
| B. | 在一定条件,香草醛可与HCHO发生缩聚反应 | |
| C. | 两种物质分别和H2反应,最多消耗H24mol和3mol | |
| D. | 可用FeCl3溶液或NaHCO3溶液鉴别化合物香草醛和青蒿酸 |
| A. | 氢氧化钠溶液 | B. | 稀硫酸 | C. | 盐酸 | D. | 稀硝酸 |
| A. | HF、HCl、HBr、HI的熔点沸点依次升高 | |
| B. | HF、HCl、HBr、HI水溶液的酸性依次升高 | |
| C. | 乙醇易溶于水,是因为乙醇分子与水分子之间只存在范德华力 | |
| D. | 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4 |
| A. | 森林遇到乱砍滥伐,破坏了生态平衡 | |
| B. | 工业上大量燃烧含硫燃料 | |
| C. | 硫酸厂排出的大量气体 | |
| D. | 大气中CO2的含量增多 |
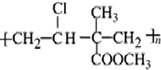 ,其单体为:CH2=CHCl、CH2=C(CH3)COOCH3.
,其单体为:CH2=CHCl、CH2=C(CH3)COOCH3.