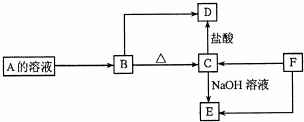
题目内容
17.X是一种碱式碳酸镁铝,现取一定质量的样品,逐渐加入某浓度盐酸充分反应,加至87.5mL时,产生气体的体积为112.0mL(标况),继续加盐酸至90mL时反应完全,又产生气体112.0mL(标况).在最后所得溶液中滴加过量的NaOH溶液,得到的白色沉淀洗涤干燥称重为3.48g.(已知A1(0H)3+NaOH═NaAlO2+2H2O)(1)求所用盐酸的物质的量的浓度;
(2)求X中Mg与A1的物质的量之比;
(3)求X的化学式.
分析 碱式碳酸镁铝与盐酸反应,首先是氢氧根离子反应,然后是碳酸根离子反应生成碳酸氢根离子,碳酸氢根离子与氢离子反应生成二氧化碳,HCO3-+H+=CO2↑+H2O,而从盐酸体积87.5mL到90mL时,90-87.5=2.5ml的盐酸与碳酸氢根离子反应生成二氧化碳,在最后所得溶液中滴加过量的NaOH溶液,得到的白色沉淀洗涤干燥称重为3.48g,也就是氢氧化镁的质量,所以物质的量为:$\frac{3.48g}{58g/mol}$=0.06mol,由此分析解答.
解答 解:碱式碳酸镁铝与盐酸反应,首先是氢氧根离子反应,然后是碳酸根离子反应生成碳酸氢根离子,碳酸氢根离子与氢离子反应生成二氧化碳,HCO3-+H+=CO2↑+H2O,而从盐酸体积87.5mL到90mL时,90-87.5=2.5ml的盐酸与碳酸氢根离子反应生成二氧化碳,在最后所得溶液中滴加过量的NaOH溶液,得到的白色沉淀洗涤干燥称重为3.48g,也就是氢氧化镁的质量,所以物质的量为:$\frac{3.48g}{58g/mol}$=0.06mol,
(1)由反应HCO3-+H+=CO2↑+H2O,二氧化碳的物质的量与盐酸的物质的量相等,盐酸的物质的量的浓度:$\frac{\frac{112×1{0}^{-3}}{22.4}mol}{2.5×1{0}^{-3}L}$=2mol/l,答:盐酸的物质的量的浓度是2mol/l;
(2)恰好完全反应生成溶质为氯化铝和氯化镁,而氯化镁的物质的量为0.06mol,所以氯化铝的物质的量为:$\frac{90×1{0}^{-3}×2mol-0.06×2}{3}$=0.02mol,所以X中Mg与A1的物质的量之比0.06:0.02=3:1,答:X中Mg与A1的物质的量之比为3:1;
(3)根据电荷守恒,得n(OH-)=2n(Mg2+)+3n(Al3+)-2n(CO32-)=2×0.06+3×0.02-2×0.01=0.2,所以n(Mg2+):n(Al3+):n(OH-):n(CO32-)=0.06:0.02:0.2:0.01=6:2:20:1,所以化学式为:Mg6Al2(OH)20CO3,答:X的化学式为Mg6Al2(OH)20CO3.
点评 本题考查相关化学方程式的计算,学生要清楚碳酸根离子与氢氧根离子共存时盐酸首先与氢氧根离子反,然后与碳酸根离子反应生成碳酸氢根,还注意电荷守恒的应用,有一定的难度.

 阅读快车系列答案
阅读快车系列答案| A. | 非自发反应在任何条件下都不能实现 | |
| B. | 自发反应都是熵增大的反应 | |
| C. | 能自发进行的吸热反应一定是熵增大的反应 | |
| D. | 自发反应都是放热反应 |
| A. | W>Y>Z>X | B. | Y>X>W>Z | C. | Y>X>Z>W | D. | Z>Y>X>W |
| A. | NaHCO3的电离方程式:NaHCO3═Na++H++CO32- | |
| B. | CaCO3的沉淀溶解平衡表达式:CaCO3(s)?Ca2+(aq)+CO32-(aq) | |
| C. | NaHS发生水解的离子方程式:HS-+H2O?S2-+H3O+ | |
| D. | 碳酸的电离方程式:H2CO3?2H++CO32- |
| A. | 1mol•L-1K2SO4溶液中含有钾离子数为2NA | |
| B. | 0.1mol铁与0.1mol氯气点燃完全反应,转移电子数为0.3NA | |
| C. | 常温常压下,6.4g氧气和臭氧混合气体中含有的原子总数为0.4NA | |
| D. | 1L1mol•L-1氨水中,含有的NH3与NH3•H20分子的总数为NA |
 元素周期表的用途广泛.
元素周期表的用途广泛.(1)用“>”或“<”填空:
| 离子半径 | 非金属性 | 酸性 | 沸点 |
| K+<S2- | N<O | 硫酸<高氯酸 | HF>HCl |
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液$→_{Ⅰ}^{80℃,通电}$NaClO3溶液$→_{Ⅱ}^{室温,KCl}$KClO3晶体
①完成Ⅰ中反应的总化学方程式:□NaCl+□H2O═□NaClO3+□3H2↑.
②Ⅱ中转化的基本反应类型是复分解反应,该反应过程能析出KClO3晶体而无其它晶体析出的原因是室温下KClO3在水中的溶解度明显小于其它晶体.
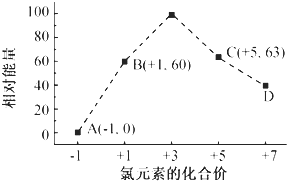
(4)一定条件,在水溶液中1mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示.
①D是ClO4-(填离子符号).
②B→A+C反应的热化学方程式为3ClO-(aq)═(aq)+2Cl-(aq)△H=-117kJ/mol(用离子符号表示)
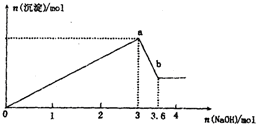 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.