题目内容
6.关于反应KIO3+6HI═3I2+KI+3H2O的说法正确的是( )| A. | 氧化剂与还原剂的物质的量之比为1:6 | |
| B. | 氧化产物与还原产物的质量之比为1:1 | |
| C. | 生成3mol水时有1mol KIO3被氧化 | |
| D. | 1mol KIO3参加反应时有5mol电子转移 |
分析 反应KIO3+6HI═3I2+KI+3H2O中,HI中I元素的化合价由-1价升高0,KIO3中I元素的化合价由+5价降低为0,以此来解答.
解答 解:A.反应中KIO3为氧化剂,HI为还原剂,氧化剂与还原剂的物质的量之比为1:5,故A错误;
B.氧化剂和还原剂的物质的量之比是1:5,故B错误;
C.KIO3为氧化剂,被还原,故C错误;
D.KIO3中I元素的化合价由+5价降低为0,则1mol KIO3参加反应时有5mol电子转移,故D正确.
故选D.
点评 本题考查氧化剂、还原剂及氧化还原反应的计算,侧重考查基本概念和计算,明确元素化合价变化即可解答,熟练掌握常见元素化合价,题目难度不大.

练习册系列答案
相关题目
5.有关化学反应的说法中,正确的是( )
| A. | 非自发反应在任何条件下都不能实现 | |
| B. | 自发反应都是熵增大的反应 | |
| C. | 能自发进行的吸热反应一定是熵增大的反应 | |
| D. | 自发反应都是放热反应 |
1.在酸性溶液中,能大量共存的离子组是( )
| A. | Mg2+、Fe3+、NO3-、SCN- | B. | Al3+、Fe2+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | Na+、Ca2+、NO3-、OH- |
11.对可逆反应4NH3(g)+5O2(g)═4NO(g)+6H2O(g)?下列叙述正确的是( )
| A. | ?达到化学平衡时?4v正(O2)=5v逆(NO) | |
| B. | ?若单位时间内生成x mol NO的同时消耗x mol NH3?则反应达到平衡状态 | |
| C. | ?达到化学平衡时若增大容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | ?当混合气体的压强不随时间变化时,此反应达平衡 |
18. 元素周期表的用途广泛.
元素周期表的用途广泛.
(1)用“>”或“<”填空:
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是bc(填序号).
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液$→_{Ⅰ}^{80℃,通电}$NaClO3溶液$→_{Ⅱ}^{室温,KCl}$KClO3晶体
①完成Ⅰ中反应的总化学方程式:□NaCl+□H2O═□NaClO3+□3H2↑.
②Ⅱ中转化的基本反应类型是复分解反应,该反应过程能析出KClO3晶体而无其它晶体析出的原因是室温下KClO3在水中的溶解度明显小于其它晶体.
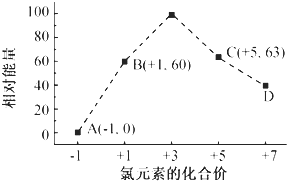
(4)一定条件,在水溶液中1mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示.
①D是ClO4-(填离子符号).
②B→A+C反应的热化学方程式为3ClO-(aq)═(aq)+2Cl-(aq)△H=-117kJ/mol(用离子符号表示)
 元素周期表的用途广泛.
元素周期表的用途广泛.(1)用“>”或“<”填空:
| 离子半径 | 非金属性 | 酸性 | 沸点 |
| K+<S2- | N<O | 硫酸<高氯酸 | HF>HCl |
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液$→_{Ⅰ}^{80℃,通电}$NaClO3溶液$→_{Ⅱ}^{室温,KCl}$KClO3晶体
①完成Ⅰ中反应的总化学方程式:□NaCl+□H2O═□NaClO3+□3H2↑.
②Ⅱ中转化的基本反应类型是复分解反应,该反应过程能析出KClO3晶体而无其它晶体析出的原因是室温下KClO3在水中的溶解度明显小于其它晶体.
(4)一定条件,在水溶液中1mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示.
①D是ClO4-(填离子符号).
②B→A+C反应的热化学方程式为3ClO-(aq)═(aq)+2Cl-(aq)△H=-117kJ/mol(用离子符号表示)
16.在密闭容器中进行的反应:N2+3H2?2NH3,下列说法正确的是( )
| A. | 加入催化剂能加快反应速率 | |
| B. | 增大压强能减慢反应速率 | |
| C. | 达到平衡时,反应速率:v(正)=v(逆)=0 | |
| D. | 达到平衡时,N2和H2能100%转化为NH3 |
 ;分子中既含有极性共价键、又含有非极性共价键的18电子化合物有H2O2、N2H4(写出其中两种的化学式).
;分子中既含有极性共价键、又含有非极性共价键的18电子化合物有H2O2、N2H4(写出其中两种的化学式).