题目内容
下物质分类组合正确的是( )
| A | B | C | D | |
| 强电解质 | AlCl3 | HClO4 | H3PO4 | HClO |
| 弱电解质 | CH3COOH | HF | BaSO4 | Ca(OH)2 |
| 非电解质 | 酒精溶液 | NH3 | H2O | SO2 |
| A、A | B、B | C、C | D、D |
考点:电解质与非电解质,强电解质和弱电解质的概念
专题:
分析:电解质是在水溶液里或熔融状态下能导电的化合物,导电本质是因电解质自身电离出自由移动的离子.
强弱电解质是根据在水溶液中电离程度划分的,与溶解度大小以及溶液的导电能力大小无关,全部电离的为强电解质,部分电离的是弱电解质.
非电解质是在水溶液里和熔融状态下都不导电的化合物.
强弱电解质是根据在水溶液中电离程度划分的,与溶解度大小以及溶液的导电能力大小无关,全部电离的为强电解质,部分电离的是弱电解质.
非电解质是在水溶液里和熔融状态下都不导电的化合物.
解答:
解:A.氯化铝是盐类,属于强电解质;醋酸是弱酸,属于弱电解质;酒精溶液是混合物,既不是电解质也不是非电解质,故A错误;
B.高氯酸是强酸,属于强电解质,氢氟酸属于弱酸为弱电解质,氨气水溶液能导电,是氨气和水形成一水合氨电离,一水合氨是电解质,氨气为非电解质,故B正确;
C.磷酸为弱电解质,BaSO4溶于水的部分完全电离,属于强电解质;H2O能发生微弱电离,生成少量氢离子和氢氧根离子,属于弱电解质,故C错误;
D.次氯酸为弱酸,属于弱电解质,氢氧化钙为强电解质,二氧化硫为非电解质,故D错误.
故选B.
B.高氯酸是强酸,属于强电解质,氢氟酸属于弱酸为弱电解质,氨气水溶液能导电,是氨气和水形成一水合氨电离,一水合氨是电解质,氨气为非电解质,故B正确;
C.磷酸为弱电解质,BaSO4溶于水的部分完全电离,属于强电解质;H2O能发生微弱电离,生成少量氢离子和氢氧根离子,属于弱电解质,故C错误;
D.次氯酸为弱酸,属于弱电解质,氢氧化钙为强电解质,二氧化硫为非电解质,故D错误.
故选B.
点评:本题考查了电解质的概念,考查了强弱电解质的区别,解题时抓住电解质必须是化合物,强电解质必须能完全电离解题,题目难度不大.

练习册系列答案
相关题目
一定温度和压强下,24.5L某种气态纯净物中含有6.02×1023个分子,这些分子由1.204×1024个原子组成,下列有关说法中不正确的是( )
| A、标准状况下该纯净物若为气态,其体积约是22.4 L |
| B、该气体中每个分子含有2个原子 |
| C、若O2在该条件下为气态,则1 mol O2在该条件下的体积也为24.5 L |
| D、该温度和压强可能是标准状况 |
下列物质属于电解质的是( )
| A、S |
| B、Cl2 |
| C、NaOH |
| D、CH4 |
 W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ar原子的最外层电子数相差1.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ar原子的最外层电子数相差1.下列说法正确的是( )| A、第一电离能:Z>Y |
| B、Y、W的最简单氢化物的水溶液都呈酸性 |
| C、W单质的水溶液具有漂白性 |
| D、W的单质可从Z的简单氢化物种置换出Z的单质 |
下列关于电离平衡常数(K)的说法正确的是( )
| A、不同浓度的同一弱电解质,其电离平衡常数(K)不同 |
| B、电离平衡常数(K)越小,表示弱电解质电离能力越弱 |
| C、多元弱酸各步电离平衡常数相互关系为:K1<K2<K3 |
| D、CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小 |
某研究性小组在CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定只有是Fe,因为加热温度不同,受热不均时会含有少量的Fe3O4为探究X的成分及含量,他们进行了如图所示实验.下列有关叙述中正确的是( )
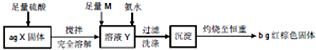

| A、取少量溶液Y,加入KSCN溶液,如果溶液不变红,则X中不含Fe3O4 | ||
| B、向钾氨水后得溶液中滴加FeCl2,如果生成红褐色沉淀,说明氨水已过量 | ||
| C、m可以是H2O2或NaClO,在实验过程中,理论上消耗两者物质的量之比为1;2 | ||
D、当b<
|
 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.实验药品:铜、铁、镁、0.5mol/LH2SO4、2mol/LH2SO4、18.4mol/LH2SO4
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.实验药品:铜、铁、镁、0.5mol/LH2SO4、2mol/LH2SO4、18.4mol/LH2SO4