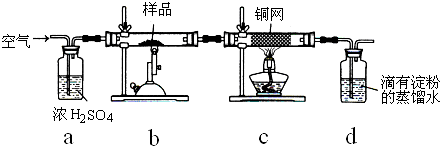
题目内容
 W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ar原子的最外层电子数相差1.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ar原子的最外层电子数相差1.下列说法正确的是( )| A、第一电离能:Z>Y |
| B、Y、W的最简单氢化物的水溶液都呈酸性 |
| C、W单质的水溶液具有漂白性 |
| D、W的单质可从Z的简单氢化物种置换出Z的单质 |
考点:微粒半径大小的比较,原子结构与元素的性质
专题:元素周期律与元素周期表专题
分析:W、X、Y、Z是四种常见的短周期元素,Y、Z两种元素的单质是空气的主要成分,Z的原子序数大于Y,可推知Z为O、Y为N,W原子的最外层电子数与Ne原子的最外层电子数相差1,则W最外层电子数为7,原子半径大于O原子半径,故W为Cl元素;X的原子序数小于N元素,而原子半径小于N原子,故X为H元素,结合元素化合物性质解答.
解答:
解:W、X、Y、Z是四种常见的短周期元素,Y、Z两种元素的单质是空气的主要成分,Z的原子序数大于Y,可推知Z为O、Y为N,W原子的最外层电子数与Ne原子的最外层电子数相差1,则W最外层电子数为7,原子半径大于O原子半径,故W为Cl元素;X的原子序数小于N元素,而原子半径小于N原子,故X为H元素,
A.Z为O、Y为N,N元素核外电子满足全满、半满稳定状态,能量较低,第一电离能高于O元素,故A错误;
B.Cl、N的最简单氢化物分别是HCl、NH3,后者的水溶液呈碱性,故B错误;
C.氯水中含有次氯酸,具有漂白性,故C正确;
D.Cl2不能从H2O中置换出O2,而是发生反应生成HCl和HClO,故D错误,
故选C.
A.Z为O、Y为N,N元素核外电子满足全满、半满稳定状态,能量较低,第一电离能高于O元素,故A错误;
B.Cl、N的最简单氢化物分别是HCl、NH3,后者的水溶液呈碱性,故B错误;
C.氯水中含有次氯酸,具有漂白性,故C正确;
D.Cl2不能从H2O中置换出O2,而是发生反应生成HCl和HClO,故D错误,
故选C.
点评:本题考查位置结构性质关系等,难度中等,推断元素是解题的关键,注意对元素周期律的理解与运用,理解同周期元素第一电离能异常的原因.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
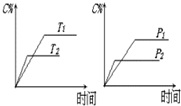 可逆反应a A(s)+b B(g)?c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )
可逆反应a A(s)+b B(g)?c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )| A、达平衡后,加入催化剂则C%增大 |
| B、达平衡后,若升温,平衡左移 |
| C、化学方程式中b<c+d |
| D、达平衡后,增加A的量有利于平衡向右移动 |
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
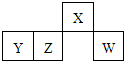
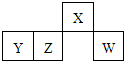
| A、原子半径:W>Z>Y>X |
| B、含Y元素的盐溶液一定显酸性 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X的氢化物能与其最高价氧化物对应的水化物反应生成盐 |
下列实验操作或数据合理的是( )
| A、用过滤的方法分离Fe(OH)3胶体和HCl溶液 |
| B、用托盘天平称取25.12gNaCl固体 |
| C、分别含有Mg2+、Cu2+和Na+的三种盐溶液,用NaOH溶液就能一次鉴别开 |
| D、从氯酸钾和二氧化锰制氧气后的混合物中分离出可溶物的操作步骤:溶解→过滤→蒸馏 |