题目内容
4.某小组设计如图装置研究电化学原理,下列说法中错误的是( )
| A. | 若开始时开关K与a连接,其反应与铁的吸氧腐蚀类似 | |
| B. | 若开始时开关K与b连接,则标准状况下B极产生2.24 L气体,转移电子0.2 mol | |
| C. | 若开始时开关K与b连接,则该装置是化学能转变为电能 | |
| D. | 若开始时开关K与b连接,其原理类似于钢铁防护中外加电流的阴极保护法 |
分析 A、若开始时开关K与a连接,构成原电池,其中的饱和食盐水呈中性,发生吸氧腐蚀;
B、若开始时开关K与b连接,是电解池,B极的电极反应式为:2H++2e-=H2↑,则标准状况下B极产生2.24 L气体物质的量为0.1mol,所以转移电子0.2 mol;
C、若开始时开关K与b连接,是电解池;
D、金属的电化学防护措施有原电池原理的牺牲阳极的阴极保护法和电解池的外加电流的阴极保护法.
解答 解:A、若开始时开关K与a连接,构成原电池,其中的饱和食盐水呈中性,所以是钢铁的吸氧腐蚀,故A正确;
B、若开始时开关K与b连接,是电解池,B极的电极反应式为:2H++2e-=H2↑,则标准状况下B极产生2.24 L气体物质的量为0.1mol,所以转移电子0.2 mol,故B正确;
C、若开始时开关K与b连接,是电解池,是将电能转化为化学能,故C错误;
D、金属的电化学防护措施有原电池原理的牺牲阳极的阴极保护法和电解池的外加电流的阴极保护法,所以开关K与b连接,故D正确;
故选C.
点评 本题考查知识点较多,明确吸氧腐蚀、电化学保护、电极反应式的书写和相关计算,题目难度不大,平时注意知识的积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.用下列装置进行实验,不能达到相应实验目的是( )
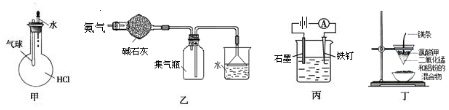

| A. | 如图装置甲:验证HCl气体在水中的溶解度大 | |
| B. | 如图装置乙:可干燥、收集氨气,并吸收多余的氨 | |
| C. | 如图装置丙:防止铁钉生锈 | |
| D. | 如图装置:可制得金属锰 |
15.下列实验能达到预期目的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 用注射器收集铜与浓硝酸反应生成的气体,然后推拉注射器 | 研究压强对化学平衡移动的影响 |
| B | 在实验室制得的乙酸乙酯中加入饱和碳酸钠溶液,然后蒸馏 | 除去乙酸乙酯中混有的乙酸、乙醇 |
| C | 用饱和FeCl3溶液制得Fe(OH)3胶体,然后过滤 | 提纯Fe(OH)3胶体 |
| D | 往混有FeCl2的CuCl2溶液中加入H2O2 后,用氨水调节pH 至2.7 后过滤 | 除去CuCl2溶液中FeCl2杂质 |
| A. | A | B. | B | C. | C | D. | D |
12.下列关于有机化合物的说法错误的是( )
| A. | 液化石油气主要含乙烯、丙烯和甲烷 | |
| B. | 航空煤油中存在烷烃的同系物 | |
| C. | 相同碳原子数的醇与卤代烃比较,醇在水中溶解度更大 | |
| D. | 聚乙烯和聚甲荃丙烯酸甲酯都是通过加聚反应制得 |
19.合成氨反应过程中的能量变化如图所示,下列说法错误的是( )
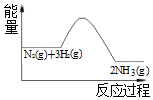

| A. | 反应体系中加入催化剂,不会改变反应的热效应 | |
| B. | 反应物的总能量高于生成物的总能量 | |
| C. | 该反应的热化学方程式为 3H2+N2?2NH3+Q(Q>0) | |
| D. | 该反应是放热反应 |
9.互为同系物的物质不具有( )
| A. | 相同的相对分子质量 | B. | 相同的通式 | ||
| C. | 相似的化学性质 | D. | 相似的结构 |
16.物质的量浓度相同的三种溶液:①氯化铵、②氨水、③硫酸氢铵,c(NH4+)大小顺序正确的是( )
| A. | ①>②>③ | B. | ③>②>① | C. | ②>③>① | D. | ③>①>② |
11.在所给的四种溶液中,各种离子能在原溶液中大量共存并形成无色溶液的是( )
| A. | 在c(H+)=10-13mol/L的溶液中:NH4+、Al3+、Fe3+、NO3- | |
| B. | pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-3mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 溶有NaHSO4的溶液中:K+、SO42-、NO3-、Al3+ |
12.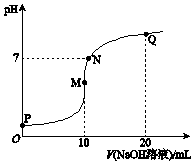 25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示.下列选项正确的是( )
25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示.下列选项正确的是( )
 25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示.下列选项正确的是( )
25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示.下列选项正确的是( )| A. | P点pH较低的主要原因是NH4+水解 | |
| B. | P、M、N、Q四点中,水的电离程度较大的是N点 | |
| C. | M点 c(Na+)>c(NH4+); N点 c(NH4+)+c(Na+)═2c(SO42-) | |
| D. | Q点 c(NH4+)+c(NH3•H2O)═c(Na+) |