题目内容
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、100 mL 1 mol?L-1的Na2CO3溶液中离子总数为0.3NA |
| B、若一筒120g的墨粉能打a个字,则平均每个字约含有10NA/a个碳原子 |
| C、在101kPa时,0.1NA个H2分子完全燃烧生成液态水,放出a kJ热量,表示氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=+20akJ?mol-1 |
| D、常温下28g14CO含有14 NA个电子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据碳酸根离子能水解分析;
B、依据质量换算物质的量,结合题干信息计算分析判断;
C、依据反应是放热反应,热化学方程式中的焓变应为负值;
D、质量换算物质的量,结合分子式计算电子数;
B、依据质量换算物质的量,结合题干信息计算分析判断;
C、依据反应是放热反应,热化学方程式中的焓变应为负值;
D、质量换算物质的量,结合分子式计算电子数;
解答:
解:A、100 mL 1 mol?L-1的Na2CO3溶液中碳酸钠物质的量为0.1mol,溶液中碳酸根离子水解,所以含有的离子物质的量小于0.3mol,故A错误;
B、120g的墨粉物质的量为10mol,即10NA个碳原子,能打a个字,则平均每个字约含有
个碳原子,故B正确;
C、0.1NA个H2分子完全燃烧生成液态水,放出a kJ热量,热化学方程式为2H2(g)+O2(g)=2H2O(l);△H=-20akJ?mol-1,故C错误;
D、28g14CO物质的量=
=
mol,含有的电子数为
×14×NA,故D错误;
故选B.
B、120g的墨粉物质的量为10mol,即10NA个碳原子,能打a个字,则平均每个字约含有
| 10NA |
| a |
C、0.1NA个H2分子完全燃烧生成液态水,放出a kJ热量,热化学方程式为2H2(g)+O2(g)=2H2O(l);△H=-20akJ?mol-1,故C错误;
D、28g14CO物质的量=
| 28g |
| 30g/mol |
| 14 |
| 15 |
| 14 |
| 15 |
故选B.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是盐类水解分析,反应焓变理解,微粒所含电子数的计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
在密闭容器中,反应X2(g)+2Y2(g)?2XY2(g)△H<0达到甲平衡,若只改变某一条件再达到乙平衡,则对此过程条件改变的分析正确的是( )
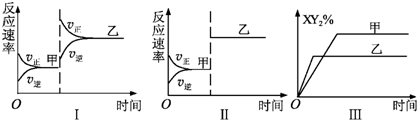

| A、图Ⅰ由甲至乙加入适当催化剂 |
| B、图Ⅱ由甲至乙扩大容器体积 |
| C、图Ⅲ由甲至乙增大压强 |
| D、图Ⅲ由甲至乙升高温度 |
某种碳酸饮料中主要含柠檬酸、碳酸、白砂糖、苯甲酸钠等成分,常温下测得其pH约为3.5,下列说法不正确的是( )
| A、柠檬酸的电离会抑制碳酸的电离 |
| B、该碳酸饮料中水的电离受到抑制 |
| C、常温下,该碳酸饮料中KW的值大于纯水中KW的值 |
| D、打开瓶盖冒出大量气泡,是因为压强减小,降低了CO2的溶解度 |
下列各溶液显酸性的是( )
| A、NaHCO3 |
| B、(NH4)2SO4 |
| C、NaCl |
| D、CH3COOK |
常温下,AgCl、AgBr、AgI的溶度积常数(Ksp)依次为1.8×10-10、5.4×10-13、8.5×10-17,下列说法错误的是( )
| A、常温下在水中的溶解能力AgCl>AgBr>AgI |
| B、在AgCl饱和溶液中加入饱和NaBr溶液有AgBr沉淀生成 |
| C、在AgBr饱和溶液中加入饱和NaCl溶液有AgCl沉淀生成 |
| D、将AgCl、AgBr和AgI的饱和溶液等体积混合,再加入足量的浓AgNO3,溶液,生成的AgI沉淀最多 |
下列实验装置或操作设计正确且能达到实验目的是( )
A、 配制一定物质的量浓度的稀硫酸 |
B、 制取少量的氢氧化铁胶体 |
C、 用硫酸标准溶液滴定氢氧化钠溶液 |
D、 称取氢氧化钠固体 |
体积相同的盐酸和醋酸两种溶液,n(Cl-)=n(CH3COO-)=0.01mol.则下列叙述正确的是( )
| A、两种溶液的pH不相同 |
| B、它们分别与足量CaCO3反应时,放出的CO2一样多 |
| C、它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多 |
| D、分别用水稀释相同倍数时,n(Cl-)=n(CH3COO-) |
 某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性强弱不同的一元酸与足量镁带反应的速率不同,但是产生的氢气的体积相同.在如图装置中的锥形瓶中分别装入l mol.L-1的盐酸和醋酸各10mL,进行实验.
某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性强弱不同的一元酸与足量镁带反应的速率不同,但是产生的氢气的体积相同.在如图装置中的锥形瓶中分别装入l mol.L-1的盐酸和醋酸各10mL,进行实验.