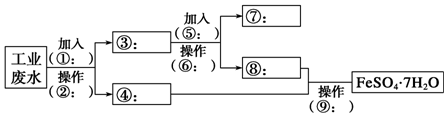
题目内容
1.在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是( )| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Fe2+、NO3-、SO42- | ||
| C. | K+、Cu2+、NH4+、Cl- | D. | Na+、K+、NO3-、HCO3- |
分析 强酸溶液含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,不发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.酸性溶液中该组离子之间不反应,可大量共存,且离子均为无色,故A选;
B.H+、Fe2+、NO3-发生氧化还原反应,不能共存,故B不选;
C.Cu2+为蓝色,与无色不符,故C不选;
D.酸溶液中不能大量存在HCO3-,故D不选;
故选A.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
11.下列反应既属于氧化还原反应,又属于放热反应的是( )
| A. | 灼热的碳与二氧化碳的反应 | |
| B. | 盐酸与烧碱溶液的反应 | |
| C. | 乙醇在空气中的燃烧 | |
| D. | 氢氧化钡晶体与氯化铵晶体在常温下的反应 |
9.几种短周期元素的原子半径及某些化合价见表,下列说法不正确的是( )
| 元素代号 | A | B | D | E | G | I | J | K |
| 化合价 | -1 | -2 | +4 -4 | -1 | +5 -3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | 常温下B元素的单质能与K单质反应 | |
| B. | A、I、J的离子半径由大到小顺序是A>J>I | |
| C. | G元素的单质存在同素异形体 | |
| D. | J在DB2中燃烧生成B元素的单质 |
16.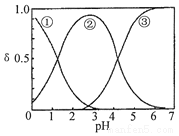 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )
 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )| A. | 曲线①代表的粒子是HC2O4- | |
| B. | 0.1mol•L-1NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| C. | pH=5时,溶液中主要含碳微粒浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) | |
| D. | 在一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)增大 |
6.某种医药中间体X,其结构简式如图.下列有关该化合物说法正确的是( )
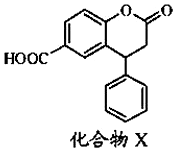

| A. | X的分子式为C15H10O4 | |
| B. | 分子中有3种含氧官能团 | |
| C. | X分子中3个六元环可能处于同一平面 | |
| D. | 即能发生酯化反应,又能发生水解反应 |
13.利用如图所示装置进行下列实验,装置正确并能达到实验目的是( )
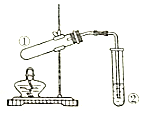

| 选项 | ①中试剂 | ②中溶液 | 实验目的 |
| A | 二氧化锰(s),浓盐酸 | 饱和食盐水 | 制取氯气 |
| B | Na2SO3(s),70%H2SO4 | 酸性高锰酸钾 | 验证SO2的还原性 |
| C | Na2CO3(s)或NaHCO3(s) | 澄清石灰水 | 鉴别Na2CO3和NaHCO3 |
| D | 乙醇、乙酸、浓硫酸 | 饱和碳酸钠 | 制取乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
17.下列离子方程式正确的是( )
| A. | 向NH4HSO3溶液中,加入过量的氢氧化钠溶液,并加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 向FeBr2溶液中通入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | FeCl3溶液与Cu的反应:Cu+2Fe3+=Cu2++2Fe2+ | |
| D. | 向次氯酸钠溶液中通入少量SO2气体:2ClO-+SO2+H2O=2HClO+SO32- |
18.下列物质的转化在给定条件下能实现的是( )
| A. | Na$→_{点燃}^{O_{2}}$Na2O$\stackrel{H_{2}O}{→}$NaOH | |
| B. | FeS2$→_{煅烧}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | SiO2$\stackrel{NaOH溶液}{→}$Na2SiO3溶液$\stackrel{盐酸}{→}$H2SiO3 | |
| D. | MgCO3$\stackrel{盐酸}{→}$MgCl2溶液$\stackrel{点解}{→}$Mg |