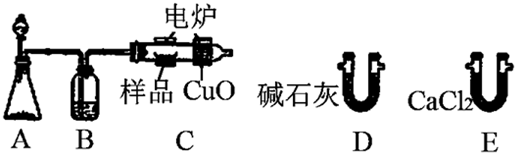
题目内容
5.在标准状况下,V L H2中含有N个氢分子,则阿伏加德罗常数为$\frac{22.4N}{V}$mol-1.分析 根据n=$\frac{V}{{V}_{m}}$计算标准状况下VL氧气的物质的量,根据N=nNA计算阿伏伽德罗常数.
解答 解:标准状况下,VL 氢气的物质的量为n=$\frac{V}{{V}_{m}}$=$\frac{V}{22.4}$mol,
所以$\frac{V}{22.4}$mol×NA=N,
解得:NA=$\frac{22.4N}{V}$mol-1,
故答案为:$\frac{22.4N}{V}$mol-1.
点评 本题考查阿伏伽德罗常数的计算,难度不大,注意公式运用,明确体积、物质的量、微粒数目的关系是解答本题的关键.

练习册系列答案
相关题目
15.下列说法中正确的一组是( )
| A. | H2和D2互为同位素 | B. |  和 和 互为同分异构体 互为同分异构体 | ||
| C. | 甲烷与乙烯是同系物 | D. |  和 和 是同一种物质 是同一种物质 |
16.下列转化必须加入氧化剂才能进行的是( )
| A. | HCO3-→CO2 | B. | MnO4-→Mn2+ | C. | Fe2+→Fe3+ | D. | Na2O2→O2 |
20. 向AlCl3溶液中逐滴加入NaOH溶液,如图,曲线①、②分别表示两种物质的物质的量的变化.其中正确的是( )
向AlCl3溶液中逐滴加入NaOH溶液,如图,曲线①、②分别表示两种物质的物质的量的变化.其中正确的是( )
 向AlCl3溶液中逐滴加入NaOH溶液,如图,曲线①、②分别表示两种物质的物质的量的变化.其中正确的是( )
向AlCl3溶液中逐滴加入NaOH溶液,如图,曲线①、②分别表示两种物质的物质的量的变化.其中正确的是( )| A. | ①Al3+ ②Al(OH)3 | B. | ①Al3+ ②AlO2- | ||
| C. | ①Al(OH)3 ②Al3+ | D. | ①AlO2- ②Al3+ |
17.下列说法正确的是( )
| A. | 对一个可逆反应,正反应方向是吸热的,当升高温度时,正反应速率增大,逆反应速率减小 | |
| B. | 正催化剂能提高活化分子百分数和活化分子浓度 | |
| C. | 压强增大,化学反应速率一定增大 | |
| D. | 浓度升高化学平衡一定发生移动 |
14.已知一种c(H+)=1×10-3 mol/L的酸和一种c(OH-)=1×10-3mol/L的碱等体积混合后溶液呈酸性,其原因可能是( )
| A. | 浓的强酸和稀的强碱反应 | B. | 浓的弱酸和稀的强碱反应 | ||
| C. | 等浓度的强酸和弱碱反应 | D. | 稀的强酸和浓的弱碱反应 |
15.下列关于离子共存或离子方程式的说法正确的是( )
| A. | 某酸性溶液中可能大量存在:NH4+、Fe3+、NO3-、I- | |
| B. | 由水电离的c(H+)=10-12 mol•L-1的溶液中,Al3+、Cl-、Ba2+、NO3-一定不能大量共存 | |
| C. | 向NH3•H2O溶液中滴加少量AlCl3溶液,发生反应:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 向含有1 mol FeBr2的水溶液中通入标准状况下11.2 L Cl2,发生反应:Cl2+2Fe2+═2Fe3++2Cl- |