题目内容
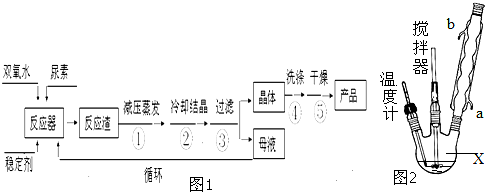
在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体.
(1)该过程的化学方程式: .
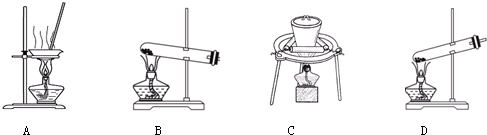
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是 .
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分.
试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸.
(1)该过程的化学方程式:
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是

(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分.
试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸.
| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解.往试管中加入 | 现象:溶液中产生大量白色沉淀; 结论: |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 | 现象: 结论:样品中含有NaHCO3. |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中, | 现象: 结论: |
考点:纯碱工业(侯氏制碱法),性质实验方案的设计
专题:实验设计题
分析:(1)反应为侯氏制碱法原理,根据反应物和生成物可确定反应的方程式;
(2)加热固体,可在坩埚或试管中进行;
(3)纯碱制品含有Na2CO3和少量NaHCO3和NaCl,检验NaHCO3可用过量的Ba(NO3)2溶液先除去Na2CO3,然后加入NaOH溶液,如生成沉淀,可说明含有NaHCO3,过滤后加入硝酸酸化,加入硝酸银可检验NaCl.
(2)加热固体,可在坩埚或试管中进行;
(3)纯碱制品含有Na2CO3和少量NaHCO3和NaCl,检验NaHCO3可用过量的Ba(NO3)2溶液先除去Na2CO3,然后加入NaOH溶液,如生成沉淀,可说明含有NaHCO3,过滤后加入硝酸酸化,加入硝酸银可检验NaCl.
解答:
解:(1)反应为侯氏制碱法原理,由反应物和生成物可知反应的方程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(2)加热固体,可在坩埚或试管中进行,则BC符合,D试管口应向下倾斜,防止试管炸裂,故答案为:BC;
(3)纯碱制品含有Na2CO3和少量NaHCO3和NaCl,检验NaHCO3可用过量的Ba(NO3)2溶液先除去Na2CO3,
然后加入NaOH溶液,如生成沉淀,可说明含有NaHCO3,原因是碳酸氢钠和氢氧化钠反应生成碳酸钠,碳酸钠和硝酸钡反应生成碳酸钡沉淀,
过滤后加入硝酸酸化,加入硝酸银可检验NaCl,故答案为:
.
(2)加热固体,可在坩埚或试管中进行,则BC符合,D试管口应向下倾斜,防止试管炸裂,故答案为:BC;
(3)纯碱制品含有Na2CO3和少量NaHCO3和NaCl,检验NaHCO3可用过量的Ba(NO3)2溶液先除去Na2CO3,
然后加入NaOH溶液,如生成沉淀,可说明含有NaHCO3,原因是碳酸氢钠和氢氧化钠反应生成碳酸钠,碳酸钠和硝酸钡反应生成碳酸钡沉淀,
过滤后加入硝酸酸化,加入硝酸银可检验NaCl,故答案为:
| 过量的Ba(NO3)2溶液 | 试样中含有Na2CO3. |
| 适量的NaOH溶液 | 有少量白色沉淀生成. |
| 先加入足量的稀硝酸,再加入少许AgNO3溶液 | 有少量白色沉淀生成;试样中含有NaCl. |
点评:本题以碳酸钠的制备为载体,综合考查物质的制备和测定,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的原理和方法,结合反应的关系式进行计算,难度中等.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
下列说法错误的是( )
| A、淀粉溶液具有丁达尔效应 |
| B、有色玻璃不属于胶体 |
| C、明矾能净水 |
| D、瓯江水是浊液、胶体、溶液组成的混合体系 |
常温下,装有氮气和氯气混合物的试管倒立于足量的水中,经足够长时间光照,试管气体体积缩小为原来的
(假定气体都存在于试管中),则原氮气和氯气的体积比为( )
| 3 |
| 5 |
| A、2:3 | B、3:2 |
| C、1:4 | D、1:6 |