题目内容
7.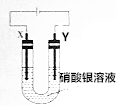 X、Y均为石墨电极,电解硝酸银溶液,实验装置如图所示,电解实验过程中,发现Y极增重的同时,Y极负极产生气泡且气泡由无色变红棕色.已知电流效率等于生成目标产物消耗电子书与电路转移总电子数之比.下列推断正确的是( )
X、Y均为石墨电极,电解硝酸银溶液,实验装置如图所示,电解实验过程中,发现Y极增重的同时,Y极负极产生气泡且气泡由无色变红棕色.已知电流效率等于生成目标产物消耗电子书与电路转移总电子数之比.下列推断正确的是( )| A. | Y极附近产生的无色气泡是H2 | |
| B. | X极附近电解质溶液中c(H+)会减小 | |
| C. | 若产生2.24L O2(标准状况下)时析出32.4g银,则电流效率为80% | |
| D. | 阴极的副反应为NO3-+3e-+4H+═NO↑+2H2O |
分析 A.Y极产生气泡且气泡由无色变红棕色,则气体为NO;
B.阳极附近水电离的氢氧根离子失电子生成氧气;
C.阳极上电极方程式为4OH--4e-=2H2O+O2↑,阴极的电极方程式为Ag++e-=Ag,根据物质与电子的关系计算;
D.阴极上硝酸根离子得电子生成NO.
解答 解:A.Y极附近产生气泡且气泡由无色变红棕色,则气体为NO,NO 被氧气氧化为红棕色的二氧化氮,不能是氢气,H2为无色气体,故A错误;
B.阳极附近水电离的氢氧根离子失电子生成氧气,其电极方程式为2H2O-4e-=4H++O2↑,所以X极附近电解质溶液中c(H+)会增大,故B错误;
C.阳极上电极方程式为4OH--4e-=2H2O+O2↑,阳极产生2.24L O2(标准状况下),则其物质的量为0.1mol,转移电子为0.4mol,阴极的电极方程式为Ag++e-=Ag,则Ag的物质的量为$\frac{32.4g}{108g/mol}$=0.3mol,即转移电子为0.3mol,所以电流效率为$\frac{0.3mol}{0.4mol}$×100%=75%,故C错误;
D.阴极上硝酸根离子得电子生成NO,即阴极的副反应为NO3-+3e-+4H+═NO↑+2H2O,故D正确.
故选D.
点评 本题考查了有关电解池的知识,侧重于学生的分析能力和计算能力的考查,注意把握电解池的工作原理以及电极方程式的书写,学习中注意相关基础知识的积累,难度中等.

练习册系列答案
相关题目
17.下列关于胶体,判断不正确的是( )
| A. | 胶体的本质特征是胶粒直径在1nm~100nm | |
| B. | 煮沸饱和FeCl3溶液可以制得Fe(OH)3胶体 | |
| C. | 丁达尔现象可以用来区别胶体和溶液 | |
| D. | 溶液和胶体的分散质都能通过滤纸孔隙 |
18.用下列实验装置进行相应实验,能达到实验目的是( )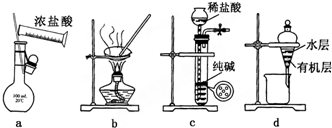

| A. | 用图a所示装置配制100mL0.100mol•L-1稀盐酸 | |
| B. | 用图b所示装置蒸干FeCl3饱和溶液制备FeCl3固体 | |
| C. | 用图c所示装置制取少量纯净的CO2气体 | |
| D. | 用图d所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
15.某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和Na+.某同学为确定其组分,设计并完成了如下实验:
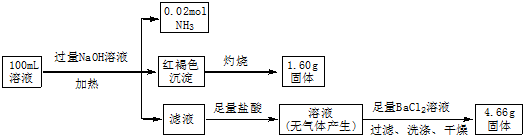
由此可推测原溶液中( )

由此可推测原溶液中( )
| A. | SO42-、NH4+和Na+ 一定存在,CO32-一定不存在 | |
| B. | SO42-、NH4+一定存在,Na+ 和CO32-一定不存在 | |
| C. | c(Fe3+)=0.1 mol•L-1 | |
| D. | c(Cl-)≥0.4mol•L-1 |
2.能正确表示下列反应的离子方程式为( )
| A. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO${\;}_{4}^{2-}$沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| B. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═AlO2-+H2↑ | |
| C. | 玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-═Na2SiO3↓+H2O | |
| D. | VO2+与酸性高锰酸钾溶液反应:5VO2++MnO${\;}_{4}^{-}$+H2O═5VO${\;}_{2}^{+}$+Mn2++2H+ |
12.自来水厂常用氯气给自来水消毒,某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是( )
| A. | 亚硫酸钠 | B. | 硝酸银 | C. | 碳酸钠 | D. | 氯化铝 |
16.下列书写或说法正确的是( )
| A. | 聚丙烯的链节是-CH2-CH2-CH2- | |
| B. | 向苯酚溶液中滴加Na2CO3溶液:2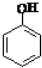 +CO${\;}_{3}^{2-}$→ +CO${\;}_{3}^{2-}$→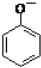 +CO2↑+H2O +CO2↑+H2O | |
| C. | 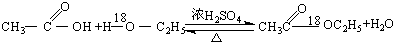 | |
| D. | 苯的同系物能使酸性高锰酸钾溶液褪色,说明烃基对苯环的性质产生了较大的影响 |