题目内容
11.常温下,0.1mol/L的硫酸铜溶液里,各离子浓度大小的顺序正确的是( )| A. | c(OH-)<c(Cu2+)<c(H+)<c(SO42-) | B. | c(OH-)<c(H+)<c(SO42-)<c(Cu2+) | ||
| C. | c(OH-)<c(H+)<c(SO42-)=c(Cu2+) | D. | c(OH-)<c(H+)<c(Cu2+)<c(SO42-) |
分析 CuSO4是强酸弱碱盐,Cu2+水解导致溶液呈酸性,溶液中存在物料守恒,结合守恒分析解答.
解答 解:CuSO4是强酸弱碱盐,Cu2+水解导致溶液呈酸性,则c(OH-)<c(H+),溶液中Cu2+水解(SO42-)不水解,根据物料守恒得c(Cu2+)<c(SO42-),溶液中Cu2+水解程度较小,则溶液中离子浓度大小顺序是c(OH-)<c(H+)<c(Cu2+)<c(SO42-),故选D.
点评 本题考查离子浓度大小比较,为高频考点,明确盐的类型、盐类水解特点、溶液中存在的守恒是解本题关键,侧重考查学生分析判断及知识运用能力,注意电荷守恒和物料守恒的灵活运用,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
1.下列物质与硝酸反应,既体现了硝酸具有强氧化性又体现了酸性的是( )
| A. | Cu | B. | C | C. | CuO | D. | CuCO3 |
2.同周期的两种主族元素A和B能够形成离子化合物AmBn,已知A的原子序数为a,则B的原子序数可能为( )
| A. | a+8+m-n | B. | a+16-m+n | C. | a+24-m-n | D. | a+18-m-n |
19.在元素周期表中,元素的金属性和非金属性及其强弱比较与周期序数(n)和主族序数(A)有如下经验公式:K=$\frac{A}{n}$(K为A与n的比值).下列推理正确的是( )
| A. | 当A一定时,K值越小,则元素的非金属性越强 | |
| B. | 当K=0,则该元素系同一周期中最活泼的金属元素 | |
| C. | 当n一定时,随着K值增大,则元素的非金属性逐渐增强 | |
| D. | 当K=l时,则该元素系过渡元素 |
6.用如图实验装置进行实验不能达到目的是( )

| 选项 | 反应及实验目的 | 试剂X | 试剂Y |
| A | 电石与饱和食盐水混合, 检验乙炔气体 | CuSO4溶液 | 酸性KMnO4溶液 |
| B | 二氧化锰与浓盐酸混合加热, 验证氯、溴、碘单质氧化性依次减弱 | NaBr溶液 | KI溶液 |
| C | 乙醇与浓硫酸加热至170℃, 证明发生了消去反应 | NaOH溶液 | Br2的CCl4溶液 |
| D | 乙酸溶液与碳酸钠固体混合, 探究乙酸、碳酸和苯酚的酸性强弱 | 饱和NaHCO3溶液 | 苯酚钠溶液 |

| A. | A | B. | B | C. | C | D. | D |
16.化学与生活息息相关.下列有关事实、原理都正确并有因果关系的是( )
| 选项 | 事实 | 原理 |
| A | 用漂白精溶液对环境消毒 | 病毒蛋白质在漂白精溶液中发生盐析现象 |
| B | 用碳酸钠溶液浸泡水垢 | 水垢中溶解度较大的物质转化为溶解度较小的物质 |
| C | 含碘的食盐密闭保存于阴凉处 | 碘化钾不稳定易分解,从而损失碘元素 |
| D | 用纯碱溶液洗涤餐具表面油污 | 碳酸钠与油脂发生复分解反应生成可溶物 |
| A. | A | B. | B | C. | C | D. | D |
3.若在NaClO3浓溶液中加入固体KCl,则可得到重要化工产品KClO3晶体.下述有关生产原理正确的是( )
| A. | 变化的化学方程式是:NaCl03+KCl=KClO3(结晶)+NaCl | |
| B. | KClO3是难溶物 | |
| C. | KClO3是比NaClO3更弱的电解质 | |
| D. | 相同温度下,KCl03的溶解度比NaCl03小 |
2.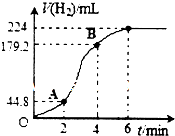 某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定锌完全消失所需的时间进行判断,其速率最快的实验是5 (填实验序号).
(2)对锌和稀硫酸反应,实验1和2表明,固体反应物的表面积对反应速率有影响;实验1和3表明,(是否形成)原电池对反应速率有影响.
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图象如右图所示.
①在OA、AB、BC三段中反应速率最快的是AB,原因是反应放热,使温度升高,反应速率加快.
②2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)=0.06mol•L-1•min-1.
 某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:| 实验 序号 | 锌的质量/g | 锌的 状态 | c(H2SO4)/mol•L-1 | V(H2SO4) /mL | 反应前溶液的温度/℃ | 添加剂 |
| 1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 20 | 2滴CuSO4溶液 |
(2)对锌和稀硫酸反应,实验1和2表明,固体反应物的表面积对反应速率有影响;实验1和3表明,(是否形成)原电池对反应速率有影响.
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图象如右图所示.
①在OA、AB、BC三段中反应速率最快的是AB,原因是反应放热,使温度升高,反应速率加快.
②2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)=0.06mol•L-1•min-1.
3.下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
| A. | 金属钠与固态水分别受热熔化 | B. | 氯化铵与苯分别受热变为气体 | ||
| C. | 氯化钠与氯化氢分别溶解在水中 | D. | 碘与干冰分别受热变为气体 |