题目内容
以石油化工的一种产品A(乙烯)为主要原料合成一种具有果香味的物质E的生产流程如下:
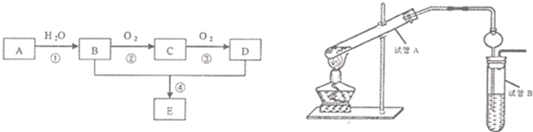
(1)写出步骤①的化学方程式 反应类型
步骤②的化学方程式 反应类型
(2)某同学欲用上图装置制备物质E,回答以下问题:
①试管A发生反应的化学方程式
②制得的物质E中常含有杂质,通常可用 (填一种试剂的名称)把乙酸乙酯分离出来,过程中应采用的实验操作是 (填操作名称),用到的主要玻璃仪器为 .
③插入右边试管的导管接有一个球状物,其作用为
(3)为了制备重要的有机原料--氯乙烷(CH3-CH2Cl),下面是两位同学设计的方案.
甲同学:选乙烷和适量氯气在光照条件下制备,原理是:CH3-CH3+Cl2
CH3-CH2Cl+HCl
乙同学:选乙烯和适量氯化氢在一定条件下制备,原理是:CH2=CH2+HCl→CH3-CH2Cl
你认为上述两位同学的方案中,合理的是 ,简述你的理由: .

(1)写出步骤①的化学方程式
步骤②的化学方程式
(2)某同学欲用上图装置制备物质E,回答以下问题:
①试管A发生反应的化学方程式
②制得的物质E中常含有杂质,通常可用
③插入右边试管的导管接有一个球状物,其作用为
(3)为了制备重要的有机原料--氯乙烷(CH3-CH2Cl),下面是两位同学设计的方案.
甲同学:选乙烷和适量氯气在光照条件下制备,原理是:CH3-CH3+Cl2
| 光照 |
乙同学:选乙烯和适量氯化氢在一定条件下制备,原理是:CH2=CH2+HCl→CH3-CH2Cl
你认为上述两位同学的方案中,合理的是
考点:乙酸乙酯的制取
专题:有机物的化学性质及推断
分析:A的产量通常用来衡量一个国家的石油化工水平,A为乙烯,A与水发生加成反应生成乙醇,故B为乙醇,乙醇氧化生成C,C氧化生成D,故C为乙醛、D是乙酸,乙酸与乙醇生成具有果香味的物质E,E为乙酸乙酯,
(1)反应①是乙烯与水发生加成反应生成乙醇,属于加成反应;反应②是乙醇催化氧化生成乙醛,属于氧化反应;
(2)①试管A中乙酸与乙醇在浓硫酸作用下加热反应生成乙酸乙酯和水,据此写出反应的化学方程式;
②乙酸乙酯在饱和碳酸钠溶液中的溶解度较小,且能够与乙酸反应、溶解乙醇;乙酸乙酯不溶于水,混合液分层,可以通过分液操作分离,使用的仪器为分液漏斗;
③右边的球形导管具有防止倒吸的作用;
(3)烷烃的取代反应是分步进行的,反应很难停留在某一步,据此进行分析.
(1)反应①是乙烯与水发生加成反应生成乙醇,属于加成反应;反应②是乙醇催化氧化生成乙醛,属于氧化反应;
(2)①试管A中乙酸与乙醇在浓硫酸作用下加热反应生成乙酸乙酯和水,据此写出反应的化学方程式;
②乙酸乙酯在饱和碳酸钠溶液中的溶解度较小,且能够与乙酸反应、溶解乙醇;乙酸乙酯不溶于水,混合液分层,可以通过分液操作分离,使用的仪器为分液漏斗;
③右边的球形导管具有防止倒吸的作用;
(3)烷烃的取代反应是分步进行的,反应很难停留在某一步,据此进行分析.
解答:
解:的产量通常用来衡量一个国家的石油化工水平,A为乙烯,A与水发生加成反应生成乙醇,故B为乙醇,乙醇氧化生成C,C氧化生成D,故C为乙醛、D是乙酸,乙酸与乙醇生成具有果香味的物质E,E为乙酸乙酯,
(1)反应①为乙烯与水发生加成反应生成乙醇,反应的方程式为:CH2=CH2+H2O
CH3-CH2OH,该反应为加成反应,
反应②为乙醇催化氧化生成乙醛,反应的方程式为:2CH3CH2OH+O2
2CH3CHO+2H2O,该反应为氧化反应,
故答案为:CH2=CH2+H2O
CH3-CH2 OH;加成反应; 2CH3CH2OH+O2
2CH3CHO+2H2O; 氧化反应;
(2)①乙酸和乙醇在浓硫酸的催化作用下发生酯化反应,生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O;
②由于乙酸乙酯在饱和碳酸钠溶液中的溶解度较小,碳酸钠溶液能够与乙酸反应,还能够溶解乙醇,所以通常用饱和碳酸钠溶液吸收乙酸乙酯;乙酸乙酯不溶于水,所以混合液会分层,乙酸乙酯在上层,可以分液操作分离出乙酸乙酯,使用的主要玻璃仪器为分液漏斗,
故答案为:饱和碳酸钠溶液;分液; 分液漏斗;
③吸收乙酸乙酯时需要容易发生倒吸现象,球形导管可以防止溶液倒吸,
故答案为:防止倒吸;
(3)烷烃的取代反应是分步进行的,反应很难停留在某一步,所以得到的产物往往是混合物;乙烯与HCl反应只有一种加成产物,所以乙同学的方案更合理,
故答案为:乙同学的方案;由于烷烃的取代反应是分步进行的,反应很难停留在某一步,所以得到的产物往往是混合物;而用乙烯与HCl反应只有一种加成产物,所以可以得到相对纯净的产物.
(1)反应①为乙烯与水发生加成反应生成乙醇,反应的方程式为:CH2=CH2+H2O
| 催化剂 |
| △ |
反应②为乙醇催化氧化生成乙醛,反应的方程式为:2CH3CH2OH+O2
| Cu |
| △ |
故答案为:CH2=CH2+H2O
| 催化剂 |
| △ |
| Cu |
| △ |
(2)①乙酸和乙醇在浓硫酸的催化作用下发生酯化反应,生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+CH3CH2OH
| 浓硫酸 |
| △ |
故答案为:CH3COOH+CH3CH2OH
| 浓硫酸 |
| △ |
②由于乙酸乙酯在饱和碳酸钠溶液中的溶解度较小,碳酸钠溶液能够与乙酸反应,还能够溶解乙醇,所以通常用饱和碳酸钠溶液吸收乙酸乙酯;乙酸乙酯不溶于水,所以混合液会分层,乙酸乙酯在上层,可以分液操作分离出乙酸乙酯,使用的主要玻璃仪器为分液漏斗,
故答案为:饱和碳酸钠溶液;分液; 分液漏斗;
③吸收乙酸乙酯时需要容易发生倒吸现象,球形导管可以防止溶液倒吸,
故答案为:防止倒吸;
(3)烷烃的取代反应是分步进行的,反应很难停留在某一步,所以得到的产物往往是混合物;乙烯与HCl反应只有一种加成产物,所以乙同学的方案更合理,
故答案为:乙同学的方案;由于烷烃的取代反应是分步进行的,反应很难停留在某一步,所以得到的产物往往是混合物;而用乙烯与HCl反应只有一种加成产物,所以可以得到相对纯净的产物.
点评:本题考查了有机物的推断、乙酸乙酯的制备、化学实验方案的评价等知识,题目难度中等,注意掌握常见有机物结构与性质、乙酸乙酯的制取方法及实验操作方法,明确化学实验方案的评价方法.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
 在密闭容器中进行下列反应:M(g)+N(g)?R(g)+2X(?),该反应中R的体积分数如图所示,下列情况正确的是( )
在密闭容器中进行下列反应:M(g)+N(g)?R(g)+2X(?),该反应中R的体积分数如图所示,下列情况正确的是( )| A、正反应为吸热反应,X为气体 |
| B、正反应为吸热反应,X为固体或液体 |
| C、正反应为放热反应,X为气体 |
| D、正反应为放热反应,X为固体或液体 |
X、Y为两种元素的原子,X的阴离子与Y的阳离子具有相同的电子层结构,由此可知( )
| A、X的原子半径大于Y的原子半径 |
| B、X的电负性小于Y的电负性 |
| C、X的阴离子半径大于Y的阳离子半径 |
| D、X的I1小于Y 的I1 |
将一定量xAl2(SO4)3?y(NH4)2SO4?24H2O晶体加入到过量NaOH溶液中,加热生成NH3 0.85g(假如生成的NH3全部逸出),再通入过量的CO2,过滤、洗涤、灼烧,得Al2O3固体2.55g.则x:y=(已知:Al2O3的相对分子质量为102;NH3的相对分子质量为17)( )
| A、1:2 | B、1:1 |
| C、1:4 | D、2:1 |
最外层为N层的基态原子中,未成对的电子数目最多为( )个.
| A、4 | B、5 | C、6 | D、7 |
价电子满足4s和3d为半满的元素是( )
| A、Ca | B、V | C、Cr | D、Cu |
经测定某种溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法错误的是( )
| A、若满足:c(Cl-)=c(NH4+)>c(OH-)=c(H+),则溶质一定是NH4Cl |
| B、若满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶质一定是NH4Cl和NH3-?H2O |
| C、溶液中四种离子之间可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D、若满足:c(NH4+)=c(Cl-),则溶液一定呈中性 |
 在实验室,可以用如图所示的装置制取乙酸乙酯.回答下列问题:
在实验室,可以用如图所示的装置制取乙酸乙酯.回答下列问题: