题目内容
9. 实验室需要0.1mol•L-1NaOH溶液500mL,根据溶液的配制情况,回答下列问题:
实验室需要0.1mol•L-1NaOH溶液500mL,根据溶液的配制情况,回答下列问题:(1)配制过程中需玻璃仪器有:烧杯、量筒、胶头滴管、玻璃棒、500mL容量瓶.
(2)要完成本实验应称量NaOH固体的质量是2.0g.
(3)配制溶液时,一般可以分为以下几个步骤:①计算;②称量;③溶解;④冷却;⑤转移;⑥洗涤;⑦定容;⑧倒转摇匀.
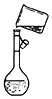
(4)如图装置是某同学配制此溶液时转移操作的示意图,图中的错误是未用玻璃棒引流.
(5)在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏低的是③④.
①容量瓶不干燥,含有少量蒸馏水
②定容时俯视刻度线
③转移溶液时不慎有少量溶液洒到容量瓶外面
④定容摇匀后发现液面低于刻度线,再补加少量蒸馏水至刻度线
(6)NaOH溶液配制完成后,取100mL该溶液与100mL盐酸溶液混合,恰好完全中和,则该盐酸溶液的物质的量浓度为0.1 mol•L-1.
分析 (1)配制溶液,在烧杯中溶解、冷却后转移到容量瓶中定容;
(2)结合m=nVM计算;
(3)配制溶液时,一般可以分为以下几个步骤:①计算;②称量;③溶解;④冷却;⑤转移;⑥洗涤;⑦定容;⑧倒转摇匀;
(4)转移液体需要玻璃棒引流;
(5)由c=$\frac{n}{V}$可知,n偏小或V偏大会引起浓度偏低;
(6)恰好完全中和,则0.1L×0.1mol/L=0.1L×c(盐酸),以此来解答.
解答 解:(1)配制溶液,在烧杯中溶解、冷却后转移到容量瓶中定容,则需玻璃仪器有:烧杯、量筒、胶头滴管、玻璃棒、500mL容量瓶,
故答案为:玻璃棒;500mL容量瓶;
(2)称量NaOH固体的质量是m=nVM=0.1mol/L×0.5L×40g/mol=2.0g,
故答案为:2.0g;
(3)配制溶液时,一般可以分为以下几个步骤:①计算;②称量;③溶解;④冷却;⑤转移;⑥洗涤;⑦定容;⑧倒转摇匀,
故答案为:溶解;洗涤;
(4)图中的错误是未用玻璃棒引流,故答案为:未用玻璃棒引流;
(5)①容量瓶不干燥,含有少量蒸馏水,对实验无影响,故不选;
②定容时俯视刻度线,V偏小,则c偏高,故不选;
③转移溶液时不慎有少量溶液洒到容量瓶外面,n偏小,c偏低,故选;
④定容摇匀后发现液面低于刻度线,再补加少量蒸馏水至刻度线,V偏大,c偏低,故选;
故答案为:③④;
(6)恰好完全中和,则0.1L×0.1mol/L=0.1L×c(盐酸),c=0.1mol/L,故答案为:0.1.
点评 本题考查配制溶液,为高频考点,把握配制溶液的仪器、步骤、误差分析为解答的关键,侧重分析与实验能力的考查,注意结合公式分析误差,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.下列说法不正确的是( )
①为了除去锅炉水垢中的CaSO4,可先用碳酸钠溶液处理,再用盐酸处理
②将硫酸铜晶体放入浓硫酸中属于物理变化
③强氧化剂与强还原剂混合,一定能发生氧化还原反应
④固态的离子化合物不导电,熔融态的离子化合物也不导电
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强.
①为了除去锅炉水垢中的CaSO4,可先用碳酸钠溶液处理,再用盐酸处理
②将硫酸铜晶体放入浓硫酸中属于物理变化
③强氧化剂与强还原剂混合,一定能发生氧化还原反应
④固态的离子化合物不导电,熔融态的离子化合物也不导电
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强.
| A. | ①④ | B. | ①④⑤ | C. | ①②③④ | D. | ②③④⑤ |
17.下列化学用语正确的是( )
| A. | Na2O2的电子式: | B. | Cl原子的结构示意图: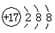 | ||
| C. | HClO分子的结构式:H-Cl-O | D. | 乙烯的结构简式:CH2CH2 |
4.下列是常用的中和胃酸的药物:
估算10片胃舒平和5片达喜,含铝的物质的量较多的是10片胃舒平.
| 药名 | 胃舒平 | 达喜 |
| 有效成分的化学式 | Al(OH)3 | Al2Mg6(OH)16CO3•4H2O |
| 相对分子质量 | 78 | 530 |
| 每片含有效成分的药量 | 0.245g | 0.5g |
1.工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同)CDE.
A、生成CH3OH的速率与消耗CO的速率相等
B、混合气体的密度不变
C、混合气体的平均相对分子质量不变
D、CH3OH、CO、H2的浓度都不再发生变化
E、容器中气体的压强不再改变
(2)表所列数据是反应在不同温度下的化学平衡常数(K).
①写出该反应的平衡常数K的表达式K=$\frac{c(C{H}_{3}OH)}{c(CO).{c}^{2}({H}_{2})}$
②由表中数据判断该反应的△H<0(填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,5min时达到平衡,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃,在0~5min内,以H2表示的平均反应速率为0.32mol•L-1•min-1,平衡时CH3OH的浓度为0.8mol•L-1•
(1)判断反应达到平衡状态的依据是(填字母序号,下同)CDE.
A、生成CH3OH的速率与消耗CO的速率相等
B、混合气体的密度不变
C、混合气体的平均相对分子质量不变
D、CH3OH、CO、H2的浓度都不再发生变化
E、容器中气体的压强不再改变
(2)表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②由表中数据判断该反应的△H<0(填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,5min时达到平衡,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃,在0~5min内,以H2表示的平均反应速率为0.32mol•L-1•min-1,平衡时CH3OH的浓度为0.8mol•L-1•
18.将气体A、B置于容积为2L的密闭容器中,发生反应:4A(g)+B(g)=2C(g)反应进行到4s末,测得C为0.2mol.则该反应速率v(C)为( )
| A. | 0.025 mol/(L•s) | B. | 0.012 5 mol/(L•s) | C. | 0.05 mol/(L•s) | D. | 0.1 mol/(L•s) |
12.下图是侯氏制碱法在实验室进行模拟实验的生产流程示意图,下列叙述错误的是( )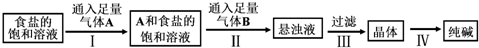
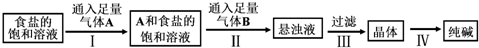
| A. | 气体A是NH3,气体B是CO2 | |
| B. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| C. | 第III步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 | |
| D. | 第Ⅳ步操作的主要过程有溶解、蒸发、结晶 |

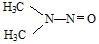 所示,1molNDMA分子中含有σ键的数目为10mol.
所示,1molNDMA分子中含有σ键的数目为10mol.