题目内容
已知NaCl中混有混有Na2CO3固体,请用简要的语言说明除去Na2CO3的方法,并写出有关反应的离子方
式: 、 .
式:
考点:离子方程式的书写
专题:
分析:除杂的原则:选用的除杂试剂不能与原有物质反应,反应后不能引入新的杂质,碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,据此解答.
解答:
解:碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,要除去Na2CO3,可选用适量的盐酸到不再产生气体,故化学方程式为:2HCl+Na2CO3=2NaCl+H2O+CO2↑,
故答案为:将混合物溶解,加入足量的盐酸,反应后将溶液加热至干;2HCl+Na2CO3=2NaCl+H2O+CO2↑.
故答案为:将混合物溶解,加入足量的盐酸,反应后将溶液加热至干;2HCl+Na2CO3=2NaCl+H2O+CO2↑.
点评:本题考查物质的分离、提纯方法,明确物质的性质和除杂的原则是解题关键,题目难度不大.

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
对下列有机反应类型的认识中,错误的是( )
A、 +HO-NO2 +HO-NO2
 +H2O;取代反应 +H2O;取代反应 | |||
| B、CH2=CH2+Br2→CH2Br-CH2Br;加成反应 | |||
C、2CH3CH2OH+O2
| |||
D、CH3COOH+CH3CH2OH
|
下列原子半径最小的是( )
| A、Na | B、S | C、Al | D、H |
 已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )| A、0~b间反应:3HSO3-+IO3-=3SO42-+I-+3H+ |
| B、a点时消耗NaHSO3的物质的量为1.2 mol |
| C、b~c间反应:I2仅是氧化产物 |
| D、c点之后碘的物质的量不变是因为还原剂消耗完全 |
下列离子方程式正确的是( )
| A、已知H2SO3的Ka1大于HClO的Ka NaClO+H2O+SO2═Na2SO3+HClO | ||||
| B、碳酸氢钠水解 HCO3-+H2O?H3O++CO32- | ||||
C、实验室制备氢氧化铁胶体 Fe3++3H2O
| ||||
| D、向NaHSO4溶液中加入Ba(OH)2溶液至刚好呈中性 H++SO42-+Ba2++OH-═BaSO4↓+H2O |
下列有关工业生产叙述正确的是( )
| A、电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |
| B、合成氨工业中,将NH3及时液化分离有利于加快反应速率 |
| C、硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高 |
| D、侯氏制碱是将CO2和NH3先后通入饱和氯化钠溶液中得碳酸氢钠固体,再灼烧制碳酸钠固体 |
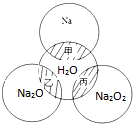 如图所示,两圆圈相交的阴影部分甲乙丙表示圆圈内物质相互发生反应,钠及其氧化物的物质的量均为0.1mol.水的质量为100g,下列说法正确的是( )
如图所示,两圆圈相交的阴影部分甲乙丙表示圆圈内物质相互发生反应,钠及其氧化物的物质的量均为0.1mol.水的质量为100g,下列说法正确的是( )| A、甲乙丙反应都属于氧化还原反应 |
| B、丙反应中的氧化剂是Na2O2,还原剂是H20 |
| C、丙反应中若消耗1molNa2O2,则转移2moL的电子 |
| D、甲乙丙反应后所得溶液的质量分数分别为ω1、ω2、ω3,则2ω1>ω2=ω3 |