题目内容
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、标准状况下,22.4LH2O含有NA个分子 |
| B、1L1mol?L -1的NaClO 溶液中含有ClO-的数目少于NA个 |
| C、0.1molAlCl3完全转化为氢氧化铝胶体,生成0.lNA个胶体粒子 |
| D、0.1molCl2与足量NaOH溶液反应,转移电子数为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.标准状况下,水的状态不是气体,不能使用气体摩尔体积计算其物质的量;
B.次氯酸根离子部分水解,溶液中次氯酸根离子数目减少;
C.氢氧化铝胶粒为氢氧化铝的聚集体,无法计算氢氧化铝胶粒的数目;
D.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂,0.1mol氯气完全反应转移了0.1mol电子.
B.次氯酸根离子部分水解,溶液中次氯酸根离子数目减少;
C.氢氧化铝胶粒为氢氧化铝的聚集体,无法计算氢氧化铝胶粒的数目;
D.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂,0.1mol氯气完全反应转移了0.1mol电子.
解答:
解:A.标况下水不是气体,不能使用标况下的气体摩尔体积计算22.4L水的物质的量,故A错误;
B.1L1mol?L -1的NaClO溶液中含有溶质次氯酸钠1mol,由于次氯酸根离子部分水解,则溶液中含有的次氯酸根离子小于1mol,ClO-的数目少于NA个,故B正确;
C.氢氧化铝胶体粒子为氢氧化铝的聚集体,则溶液中含有的胶粒小于0.1mol,故C错误;
D.0.1mol氯气与足量氢氧化钠溶液转移了0.1mol电子,转移电子数为0.1NA,故D错误;
故选B.
B.1L1mol?L -1的NaClO溶液中含有溶质次氯酸钠1mol,由于次氯酸根离子部分水解,则溶液中含有的次氯酸根离子小于1mol,ClO-的数目少于NA个,故B正确;
C.氢氧化铝胶体粒子为氢氧化铝的聚集体,则溶液中含有的胶粒小于0.1mol,故C错误;
D.0.1mol氯气与足量氢氧化钠溶液转移了0.1mol电子,转移电子数为0.1NA,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下水、乙醇、三氧化硫等物质的状态不是气体,选项C为易错点,注意氢氧化铝胶粒为氢氧化铝的聚集体.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、1.0mol?L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- | ||
B、
| ||
| C、pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- | ||
| D、c(ClO-)=1.0 mol?L-1的溶液:Na+、SO32-、S2-、SO42- | ||
| E、与铝反应产生H2的溶液中:NO3-、Na+、Cl-、K+ |
有如下三个热化学方程式:
H2(g)+
O2(g)═H2O(g)△H=a kJ?mol-1
H2(g)+
O2(g)═H2O(l)△H=b kJ?mol-1
2H2(g)+O2(g)═2H2O(l)△H=c kJ?mol-1
关于它们的下列表述正确的是( )
H2(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
2H2(g)+O2(g)═2H2O(l)△H=c kJ?mol-1
关于它们的下列表述正确的是( )
| A、它们都是吸热反应 |
| B、a、b和c均为正值 |
| C、a<b |
| D、2b=c |
在硫酸铝、硫酸和硫酸镁的混合溶液1000mL中,c(Al3+)=0.2mol/L,当加入等体积1.6mol/L KOH溶液时,生成的沉淀最多,再加入过量的KOH溶液后,经过滤、洗涤、干燥,得白色沉淀11.6g.则反应前的混合溶液中c(H2SO4)是( )
| A、0.20mol/L |
| B、0.30mol/L |
| C、0.40mol/L |
| D、0.60mol/L |
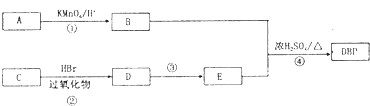 增塑剂是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、洒类等行业.DBP是增塑剂的一种,分子式为C16H22O4,可由常见的工业原料A(分子式为C8H10)和C合成DBP的路线如图所示:
增塑剂是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、洒类等行业.DBP是增塑剂的一种,分子式为C16H22O4,可由常见的工业原料A(分子式为C8H10)和C合成DBP的路线如图所示: