题目内容
有如下三个热化学方程式:
H2(g)+
O2(g)═H2O(g)△H=a kJ?mol-1
H2(g)+
O2(g)═H2O(l)△H=b kJ?mol-1
2H2(g)+O2(g)═2H2O(l)△H=c kJ?mol-1
关于它们的下列表述正确的是( )
H2(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
2H2(g)+O2(g)═2H2O(l)△H=c kJ?mol-1
关于它们的下列表述正确的是( )
| A、它们都是吸热反应 |
| B、a、b和c均为正值 |
| C、a<b |
| D、2b=c |
考点:反应热的大小比较
专题:
分析:燃烧反应为放热反应,则△H<0,物质的聚集状态不同,反应放出的热量不同,热化学反应方程式中物质的量与反应放出的热量成正比,以此来解答.
解答:
解:A.因燃烧反应为放热反应,则氢气燃烧是放热反应,故A错误;
B.放热反应的△H<0,则a、b和c均为负值,故B错误;
C.因水的状态不同,液态水变为气态水是吸热过程,所以a>b,故C错误;
D.热化学反应方程式中物质的量与反应放出的热量成正比,则反应热的关系为2b=c,故D正确;
故选D.
B.放热反应的△H<0,则a、b和c均为负值,故B错误;
C.因水的状态不同,液态水变为气态水是吸热过程,所以a>b,故C错误;
D.热化学反应方程式中物质的量与反应放出的热量成正比,则反应热的关系为2b=c,故D正确;
故选D.
点评:本题考查燃烧反应的热化学反应方程式,注意物质的状态、化学计量数与反应热的关系即可解答,题目难度不大.

练习册系列答案
相关题目
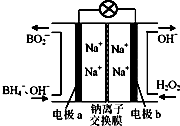 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A、电池放电时Na+从b极区移向a极区 |
| B、每消耗3 mol H2O2,转移的电子为3 mol |
| C、电极a采用MnO2,MnO2既作电极材料又有催化作用 |
| D、该电池的负极反应式为:BH4-+8OH--8e-=BO2-+6H2O |
农药波尔多液不能用铁制容器盛放,是因铁能与该农药中的硫酸铜起反应.在该反应中,铁是( )
| A、氧化剂 | B、还原剂 |
| C、催化剂 | D、漂白剂 |
下列关于胶体的说法正确的是( )
| A、胶体与其他分散系的本质区别是粒子直径的大小 |
| B、Fe(OH)3胶体能产生丁达尔效应 |
| C、明矾净水是利用胶体的吸附性 |
| D、雾、豆浆、淀粉溶液属于胶体 |
把VL含有MgSO4与K2SO4的混合溶液分成两等份,一份加入含amol NaOH的溶液,恰好使镁离子完全沉淀为Mg(OH)2;另一份加入含bmol BaCl2的溶液,恰好使SO42-完全沉淀为BaSO4,则原混合溶液中钾离子的浓度为
( )
( )
A、
| ||
B、
| ||
C、
| ||
D、
|
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、标准状况下,22.4LH2O含有NA个分子 |
| B、1L1mol?L -1的NaClO 溶液中含有ClO-的数目少于NA个 |
| C、0.1molAlCl3完全转化为氢氧化铝胶体,生成0.lNA个胶体粒子 |
| D、0.1molCl2与足量NaOH溶液反应,转移电子数为0.2NA |
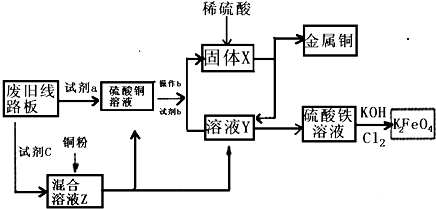 根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4).据此回答问题:
根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4).据此回答问题: