题目内容
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、1.0mol?L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- | ||
B、
| ||
| C、pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- | ||
| D、c(ClO-)=1.0 mol?L-1的溶液:Na+、SO32-、S2-、SO42- | ||
| E、与铝反应产生H2的溶液中:NO3-、Na+、Cl-、K+ |
考点:离子共存问题
专题:
分析:A.离子之间发生氧化还原反应;
B.
=10-10的溶液,显碱性;
C.pH=0的溶液显酸性;
D.离子之间发生氧化还原反应;
E.与铝反应产生H2的溶液,为非氧化性酸或强碱溶液.
B.
| c(H+) |
| c(OH-) |
C.pH=0的溶液显酸性;
D.离子之间发生氧化还原反应;
E.与铝反应产生H2的溶液,为非氧化性酸或强碱溶液.
解答:
解:A.H+、Fe2+、NO3-发生氧化还原反应,不能大量共存,故A错误;
B.
=10-10的溶液,显酸性,该组离子之间不反应,可大量共存,故B正确;
C.pH=0的溶液显酸性,不能大量存在Ag(NH3)2+,故C错误;
D.ClO-分别与SO32-、S2-发生氧化还原反应,不能大量共存,故D错误;
E.与铝反应产生H2的溶液,为非氧化性酸或强碱溶液,酸溶液中Al、H+、NO3-发生氧化还原反应不生成氢气,故E错误;
故选B.
B.
| c(H+) |
| c(OH-) |
C.pH=0的溶液显酸性,不能大量存在Ag(NH3)2+,故C错误;
D.ClO-分别与SO32-、S2-发生氧化还原反应,不能大量共存,故D错误;
E.与铝反应产生H2的溶液,为非氧化性酸或强碱溶液,酸溶液中Al、H+、NO3-发生氧化还原反应不生成氢气,故E错误;
故选B.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的考查,选项C为解答的难点,题目难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
化学已经渗透到人类生活的各个方面,下列说法不正确的是( )
| A、日本福岛核电站泄露的放射性物质131I和127I互为同位素,化学性质几乎相同 |
| B、“光化学烟雾”、“硝酸酸雨”的形成都与氮氧化合物有关 |
| C、汽油中添加Pb(C2H5)4,提高汽油的抗爆震性能,有利于改善大气环境 |
| D、低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
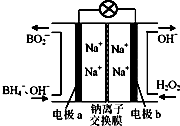 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A、电池放电时Na+从b极区移向a极区 |
| B、每消耗3 mol H2O2,转移的电子为3 mol |
| C、电极a采用MnO2,MnO2既作电极材料又有催化作用 |
| D、该电池的负极反应式为:BH4-+8OH--8e-=BO2-+6H2O |
农药波尔多液不能用铁制容器盛放,是因铁能与该农药中的硫酸铜起反应.在该反应中,铁是( )
| A、氧化剂 | B、还原剂 |
| C、催化剂 | D、漂白剂 |
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、标准状况下,22.4LH2O含有NA个分子 |
| B、1L1mol?L -1的NaClO 溶液中含有ClO-的数目少于NA个 |
| C、0.1molAlCl3完全转化为氢氧化铝胶体,生成0.lNA个胶体粒子 |
| D、0.1molCl2与足量NaOH溶液反应,转移电子数为0.2NA |
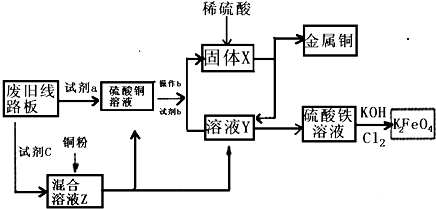 根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4).据此回答问题:
根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4).据此回答问题: 材料的不断发展可以促进社会进步.
材料的不断发展可以促进社会进步.