��Ŀ����
 ��1��������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�����ȼ����ֵ�ߣ�ʵ���ã��ڳ��³�ѹ�£�1gH2��ȫȼ������Һ̬ˮ���ų� 142.9kJ ���������ܱ�ʾH2��ȼ���ȵ��Ȼ�ѧ����ʽΪ
��1��������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�����ȼ����ֵ�ߣ�ʵ���ã��ڳ��³�ѹ�£�1gH2��ȫȼ������Һ̬ˮ���ų� 142.9kJ ���������ܱ�ʾH2��ȼ���ȵ��Ȼ�ѧ����ʽΪ��2��ȼ�ϵ������ת���ʸߣ����й����ķ�չǰ�������ü���ȼ�ϵ�ؽ�����ͼ��ʾʵ�飺�ٸü���ȼ�ϵ���У������ĵ缫��ӦʽΪ
����ͼ1װ���У�ijһͭ�缫���������� 6.4g���� a �������ĵ�O2�ڱ�״���µ����Ϊ
��3�������Ǻϳɰ�����Ҫԭ�ϣ��ϳɰ���Ӧ�Ļ�ѧ����ʽ���£�N2+3H2?2NH3����H��0
�ٵ��ϳɰ���Ӧ�ﵽƽ��ı�ijһ������������ı�N2��H2��NH3����������Ӧ������ʱ��Ĺ�ϵ��ͼ2��ʾ��ͼ��t3 ʱ����ƽ���ƶ�������������
���¶�ΪT��ʱ����2amolH2��amolN2����0.5L�ܱ������У���ַ�Ӧ����N2��ת����Ϊ50%����Ӧ��ƽ�ⳣ��Ϊ
������a mol NH3����������Ϊԭ����ȡNH4NO3������һϵ��ת����Ӧ����Ӧ������м���bgˮ���õ��ܶ�Ϊ��g/mL����Һ���������Һ��NH4NO3���ʵ���Ũ�ȵ����ֵ��
���㣺ԭ��غ͵��صĹ���ԭ��,���ʵ���Ũ�ȵ���ؼ���,�Ȼ�ѧ����ʽ,�û�ѧƽ�ⳣ�����м���,��ѧƽ���Ӱ������
ר�⣺
��������1��ȼ������1mol��ȼ����ȫȼ�������¶�������ʱ�ų��������Լ����ʵ��������������ȣ�
��2���ټ��Լ���ȼ�ϵ���У������ϼ���ʧ���Ӻ����������ӷ�Ӧ����̼�����
�ڸ���ת�Ƶ�����Ƚ��м��㣻
��3���ٸ���ͼ�����Ӱ��ƽ������أ���Ҫ�Ƿ�Ӧ���з�������ʵı仯����������
�ڻ�ѧƽ�ⳣ������������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ��������ʽ���м��㣻
���������⣬���̶ȵ���������泥���Ϸ���ʽ������������������ʵ������������������淋����ʵ���Ũ�ȣ�
��2���ټ��Լ���ȼ�ϵ���У������ϼ���ʧ���Ӻ����������ӷ�Ӧ����̼�����
�ڸ���ת�Ƶ�����Ƚ��м��㣻
��3���ٸ���ͼ�����Ӱ��ƽ������أ���Ҫ�Ƿ�Ӧ���з�������ʵı仯����������
�ڻ�ѧƽ�ⳣ������������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ��������ʽ���м��㣻
���������⣬���̶ȵ���������泥���Ϸ���ʽ������������������ʵ������������������淋����ʵ���Ũ�ȣ�
���
�⣺��1����298K��101kPaʱ��2g ��1molH2��ȫȼ������Һ̬ˮ���ų�285.8kJ���������ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪ��H2��g��+
O2��g��=H2O��l����H=-285.8kJ/mol��
�ʴ�Ϊ��H2��g��+
O2��g��=H2O��l����H=-285.8kJ/mol��
��2���ټ��Լ���ȼ�ϵ���У������ϼ���ʧ���Ӻ����������ӷ�Ӧ����̼������缫��ӦʽΪCH4+10OH--8e-=CO32-+7H2O���ʴ�Ϊ��CH4+10OH--8e-=CO32-+7H2O��
�ڴ�����·��ת�Ƶ�����ȣ��������������=
��22.4=1.12L���ʴ�Ϊ��1.12��
��3��N2��g��+3H2��g��?2NH3��g����H=-92.4kJ/mol����Ӧ�Ƿ��ȷ�Ӧ����Ӧǰ�����������С��
���ɷ�Ӧ������ʱ��Ĺ�ϵͼ���֪��t1ʱ���淴Ӧ���ʶ�����ƽ�������ƶ�������ƽ���ƶ�����������������ѹǿ��t3ʱ�����淴Ӧ���ʾ�Ѹ��������ƽ��������У��������İٷֺ����Ǽ�С�ģ�����ʾƽ��������NH3�ĺ�����ߵ�һ��ʱ����t2-t3��
�ʴ�Ϊ������ѹǿ��t2-t3��
��N2��g��+3H2��g��?2NH2��g��
��ʼ 2amol/L 4amol/L 0
��Ӧ amol/L 3amol/L 2amol/L
ƽ�� amol/L amol/L 2amol/L
���Ի�ѧƽ�ⳣ��K=
=
��L/mol��2��
�ʴ�Ϊ��
��
����a mol NH3����x mol�����������ᣬ���ࣨa-x�� mol NH3�����ɵ�����ǡ����ȫ��Ӧ����NH4NO3��
��4NH3+5O2�T4NO+6H2O��4NO+3O2+2H2O�T4HNO3��
NH3��NO��HNO3 NH3 +HNO3 �TNH4NO3
x mol x mol x mol ��a-x��mol x mol
�����⣬���̶���ȡNH4NO3����Ӧ�����㣨a-x��=x��
���x=
��
������������ʵ���Ũ���ǣ�c��NH4NO3���T
=
=
=
mol/L��
������淋����ʵ���Ũ��
mol/L��
| 1 |
| 2 |
�ʴ�Ϊ��H2��g��+
| 1 |
| 2 |
��2���ټ��Լ���ȼ�ϵ���У������ϼ���ʧ���Ӻ����������ӷ�Ӧ����̼������缫��ӦʽΪCH4+10OH--8e-=CO32-+7H2O���ʴ�Ϊ��CH4+10OH--8e-=CO32-+7H2O��
�ڴ�����·��ת�Ƶ�����ȣ��������������=
| ||
| 4 |
��3��N2��g��+3H2��g��?2NH3��g����H=-92.4kJ/mol����Ӧ�Ƿ��ȷ�Ӧ����Ӧǰ�����������С��
���ɷ�Ӧ������ʱ��Ĺ�ϵͼ���֪��t1ʱ���淴Ӧ���ʶ�����ƽ�������ƶ�������ƽ���ƶ�����������������ѹǿ��t3ʱ�����淴Ӧ���ʾ�Ѹ��������ƽ��������У��������İٷֺ����Ǽ�С�ģ�����ʾƽ��������NH3�ĺ�����ߵ�һ��ʱ����t2-t3��
�ʴ�Ϊ������ѹǿ��t2-t3��
��N2��g��+3H2��g��?2NH2��g��
��ʼ 2amol/L 4amol/L 0
��Ӧ amol/L 3amol/L 2amol/L
ƽ�� amol/L amol/L 2amol/L
���Ի�ѧƽ�ⳣ��K=
| (2amol/L) 2 |
| (amol/L)?(amol/L)3 |
| 4 |
| a2 |
�ʴ�Ϊ��
| 4 |
| a2 |
����a mol NH3����x mol�����������ᣬ���ࣨa-x�� mol NH3�����ɵ�����ǡ����ȫ��Ӧ����NH4NO3��
��4NH3+5O2�T4NO+6H2O��4NO+3O2+2H2O�T4HNO3��
NH3��NO��HNO3 NH3 +HNO3 �TNH4NO3
x mol x mol x mol ��a-x��mol x mol
�����⣬���̶���ȡNH4NO3����Ӧ�����㣨a-x��=x��
���x=
| a |
| 2 |
������������ʵ���Ũ���ǣ�c��NH4NO3���T
| n |
| V |
| n(�����) | ||
|
| ||||
|
| 500a�� |
| 40a+b |
������淋����ʵ���Ũ��
| 500a�� |
| 40a+b |
������������һ����ѧ��ҵ�������ϵ���Ŀ���漰��������ԭ��Ӧ������ʽ����д����ѧƽ���ƶ������ԭ�������ݷ���ʽ�ļ���ȣ�����ѧ�������ͽ��������������Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
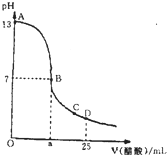 �����£���25mL 0.1mol/L NaOH��Һ����μ���0.2mol/L CH3COOH��Һ��������ͼ������������Һ���ʱ������仯���й�����Ũ�ȱȽϻ�˵����ȷ���ǣ�������
�����£���25mL 0.1mol/L NaOH��Һ����μ���0.2mol/L CH3COOH��Һ��������ͼ������������Һ���ʱ������仯���й�����Ũ�ȱȽϻ�˵����ȷ���ǣ�������| A����A��B����һ�㣬��Һ��һ������c��Na+��+c��H+��=c��CH3COO-��+c��OH-�� |
| B����B��ʱ��a=12.5 |
| C����C�㣺c��CH3COO-����c��Na+����c��H+����c��OH-�� |
| D����D�㣺c��CH3COO-��=c��CH3COOH�� |
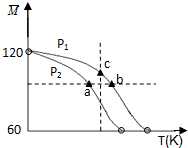 ��֪ ��CH3COOH��2��g��?2CH3COOH ��g������ʵ���ò�ͬѹǿ�£���ϵ��ƽ��Ħ��������
��֪ ��CH3COOH��2��g��?2CH3COOH ��g������ʵ���ò�ͬѹǿ�£���ϵ��ƽ��Ħ��������. |
| M |
| m�� |
| n�� |
| A���ù��̵ġ�H��0 |
| B������ѹǿ��P��a����P��b��=P��c�� |
| C��ƽ�ⳣ����K��a��=K��b����K��c�� |
| D���ⶨ�������Է�������Ҫ�ڸ�ѹ���������� |
ij������ϡ���ᷴӦ����һ�������Σ������������ȷֽ�����NO2��O2��һ�ֹ��壬�ù����н���Ԫ�صĻ��ϼ۱�ԭ�������иý����Ļ��ϼ۸ߣ���������ηֽ�����ɵ�NO2��O2�����ʵ���֮��Ϊ��������
| A��8��1 | B��4��1 |
| C��2��1 | D��1��1 |
����˵����ȷ���ǣ�������
| A��Ǧ���طŵ�ʱ�������ͳ��ʱ�ĸ���������������Ӧ |
| B���ñ���Na2CO3��Һ����BaSO4�������ɽ�BaSO4ת��ΪBaCO3 |
| C��һ���¶��£���ӦMg��1��+Cl2��g���TMgCl2��1���ġ�H��0����S��0 |
| D��pH=5��CH3COOH��Һ��pH=5��NH4C1��Һ�У�ˮ�ĵ���̶���ͬ |
�������������ڵ���ʣ����ڸ��������²��ܵ�����ǣ�������
| A��Һ̬�廯�� | B������ |
| C���� | D��ϡ���� |
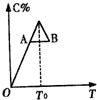 ���ڷ�Ӧ2A+B?2C�ķ�Ӧ������C�İٷֺ������¶ȱ仯��ͼ��ʾ����
���ڷ�Ӧ2A+B?2C�ķ�Ӧ������C�İٷֺ������¶ȱ仯��ͼ��ʾ���� �л�����������ת����ϵ��
�л�����������ת����ϵ��