题目内容
 已知 (CH3COOH)2(g)?2CH3COOH (g),经实验测得不同压强下,体系的平均摩尔质量(
已知 (CH3COOH)2(g)?2CH3COOH (g),经实验测得不同压强下,体系的平均摩尔质量(. |
| M |
| m总 |
| n总 |
| A、该过程的△H<0 |
| B、气体压强:P(a)<P(b)=P(c) |
| C、平衡常数:K(a)=K(b)<K(c) |
| D、测定乙酸的相对分子质量要在高压、低温条件 |
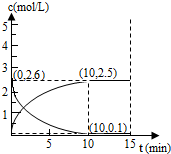
考点:体积百分含量随温度、压强变化曲线
专题:
分析:A、温度升高平均摩尔质量减小,气体质量不变,物质的量增大,说明平衡正反应方向进行,升温平衡向吸热反应方向进行;
B、bc点是压强相同条件下的化学平衡,依据图象分析可知温度不变时,增大压强,气体物质的量减小,气体摩尔质量越大,P1>P2;
C、平衡常数随温度变化而不随压强变化;
D、反应是气体体积增大的吸热反应,测定乙酸的相对分子质量应使平衡正向进行选择条件.
B、bc点是压强相同条件下的化学平衡,依据图象分析可知温度不变时,增大压强,气体物质的量减小,气体摩尔质量越大,P1>P2;
C、平衡常数随温度变化而不随压强变化;
D、反应是气体体积增大的吸热反应,测定乙酸的相对分子质量应使平衡正向进行选择条件.
解答:
解:A、温度升高平均摩尔质量减小,气体质量守恒,物质的量增大,说明平衡正反应方向进行,升温平衡向吸热反应方向进行,反应是吸热反应,△H>0,故A错误;
B、bc点是压强相同条件下的化学平衡,依据图象分析可知温度不变时,增大压强,气体物质的量减小,气体摩尔质量越大,P1>P2,则P(a)<P(b)=P(c),故B正确;
C、平衡常数随温度变化不随压强变化,abc点的温度不同,温度越高平衡常数越大,平衡常数K(b)>K(c)>K(a),故C错误;
D、反应是气体体积增大的吸热反应,测定乙酸的相对分子质量应使平衡正向进行,需要在低压高温条件下进行乙提高乙酸的纯度,故D错误.
故选:B.
B、bc点是压强相同条件下的化学平衡,依据图象分析可知温度不变时,增大压强,气体物质的量减小,气体摩尔质量越大,P1>P2,则P(a)<P(b)=P(c),故B正确;
C、平衡常数随温度变化不随压强变化,abc点的温度不同,温度越高平衡常数越大,平衡常数K(b)>K(c)>K(a),故C错误;
D、反应是气体体积增大的吸热反应,测定乙酸的相对分子质量应使平衡正向进行,需要在低压高温条件下进行乙提高乙酸的纯度,故D错误.
故选:B.
点评:本题考查了化学平衡影响因素的分析判断,图象分析方法的掌握是解题关键,题目难度较大.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
一定温度下可逆反应:A(s)+2B(g)?2C(g)+D(g);△H>0.现将1molA和2molB加入甲容器中,将4molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )


| A、保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的度的2倍 |
| B、保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 |
| C、保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
| D、保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
一定温度下,用水稀释0.1mol?L-1的一元弱酸HA,随着水量的增加,下列数值一定增大的是( )
| A、Kw |
| B、c(H+)/Ka |
| C、c(HA)/c(A-) |
| D、c(OH-) |
25℃时,几种弱酸的电离常数如下:弱酸的化学式CH3COOH、HCN、H2S电离常数(25℃)1.8×10-5 4.9×10-10 K1=1.3×10-7 K2=7.1×10-15 25℃时,下列说法正确的是( )
| A、等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) |
| B、a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b |
| C、NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| D、某浓度的NaCN溶液的pH=d,则其中由水电离出的c(H+)=10-dmol/L |
下列各组离子在相应的条件下能大量共存的是( )
| A、在c(H+)/c(OH-)=1×10-14的溶液中:NH4+、Ca2+、Cl-、K+ |
| B、水电离的c(H+)=10-13mol?L-1的溶液中:Fe3+、SO42-、K+、SCN- |
| C、在c(H+)=10-14mol/L的溶液中可能含:Na+,AlO22-,CO32-,SO32- |
| D、c(OH-)=1×10-14mol/L的溶液中:Na+、K+、Cl-、S2O32- |
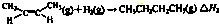
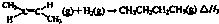
 如图为实验室制备乙烯的装置图,请回答:
如图为实验室制备乙烯的装置图,请回答:
 (1)氢气是一种新型的绿色能源,又是一种重要的化工原料.氢气燃烧热值高.实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出 142.9kJ 热量.则能表示H2标准燃烧热的热化学方程式为
(1)氢气是一种新型的绿色能源,又是一种重要的化工原料.氢气燃烧热值高.实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出 142.9kJ 热量.则能表示H2标准燃烧热的热化学方程式为