题目内容
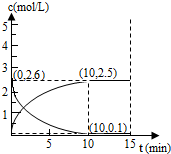
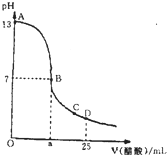 室温下,向25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图,若忽略两溶液混合时的体积变化,有关粒子浓度比较或说法正确的是( )
室温下,向25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图,若忽略两溶液混合时的体积变化,有关粒子浓度比较或说法正确的是( )| A、在A、B间任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| B、在B点时:a=12.5 |
| C、在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、在D点:c(CH3COO-)=c(CH3COOH) |
考点:中和滴定,离子浓度大小的比较
专题:电离平衡与溶液的pH专题
分析:向25mL0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,二者之间相互反应,当恰好完全反应时,所需醋酸的体积为12.5mL,当反应至溶液显中性时,醋酸应稍过量,且c(OH-)=c(H+),注意根据电荷守恒思想来比较离子浓度大小.
解答:
解:A、在A、B间任一点,溶液中只存在四种离子有Na+、H+、CH3COO-、OH-,根据电荷守恒则有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故A正确;
B、在B点溶液显中性,反应生成的醋酸钠和剩余的醋酸,醋酸钠的水解程度和醋酸的电离程度相等,醋酸过量,故有a>12.5mL,故B错误;
C、在C点,醋酸过量,溶液显酸性,故有c(OH-)<c(H+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)<c(CH3COO-),所以溶液中离子浓度大小关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;
D、在D点时,醋酸剩余,剩余的醋酸的浓度和生成的醋酸钠浓度相等均为0.05mol/l,醋酸钠的水解程度小于醋酸的电离程度,所以c(CH3COO-)<c(CH3COOH),故D错误;
故选AC.
B、在B点溶液显中性,反应生成的醋酸钠和剩余的醋酸,醋酸钠的水解程度和醋酸的电离程度相等,醋酸过量,故有a>12.5mL,故B错误;
C、在C点,醋酸过量,溶液显酸性,故有c(OH-)<c(H+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)<c(CH3COO-),所以溶液中离子浓度大小关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;
D、在D点时,醋酸剩余,剩余的醋酸的浓度和生成的醋酸钠浓度相等均为0.05mol/l,醋酸钠的水解程度小于醋酸的电离程度,所以c(CH3COO-)<c(CH3COOH),故D错误;
故选AC.
点评:本题考查了酸碱混合后的定性判断及溶液中离子浓度大小比较,题目难度中等,能够根据电荷守恒、物料守恒等比较溶液中离子浓度大小,试题培养了学生灵活应用的所学知识的能力.

练习册系列答案
相关题目
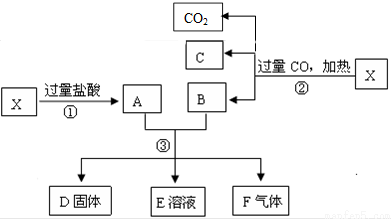
 如图为实验室制备乙烯的装置图,请回答:
如图为实验室制备乙烯的装置图,请回答:
 (1)氢气是一种新型的绿色能源,又是一种重要的化工原料.氢气燃烧热值高.实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出 142.9kJ 热量.则能表示H2标准燃烧热的热化学方程式为
(1)氢气是一种新型的绿色能源,又是一种重要的化工原料.氢气燃烧热值高.实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出 142.9kJ 热量.则能表示H2标准燃烧热的热化学方程式为