题目内容
16.0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,则该烃的分子式为C6H12.若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2,2-二甲基丁烷,则该烃结构简式为(CH3)3CCH=CH2,名称是3,3-二甲基-1-丁烯,该加成反应的化学方程式为(CH3)3CCH=CH2+Br2→(CH3)3CCHBrCH2Br.分析 0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,根据原子守恒可知,该烃的分子式为C6H12,该烃能使溴水褪色,说明分子中含有1个C=C键,该烃属于烯烃,在催化剂作用下与H2加成生成2.2-二甲基丁烷( ),相邻两个碳原子都含有H原子为C=C双键位置,确定该烃的结构简式,以此解答该题.
),相邻两个碳原子都含有H原子为C=C双键位置,确定该烃的结构简式,以此解答该题.
解答 解:0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,根据原子守恒可知,该烃的分子中N(C)=$\frac{0.6mol}{0.1mol}$=6,N(H)=$\frac{0.6mol×2}{0.1mol}$=12,故该烃的分子式为C6H12,
该烃能使溴水褪色,说明分子中含有1个C=C键,该烃属于烯烃,在催化剂作用下与H2加成生成2,2-二甲基丁烷( ),相邻两个碳原子都含有H原子为C=C双键位置,该烃的结构简式为:(CH3)3CCH=CH2,名称为3,3-二甲基-1-丁烯,与溴水反应的方程式为:(CH3)3CCH=CH2+Br2→(CH3)3CCHBrCH2Br,
),相邻两个碳原子都含有H原子为C=C双键位置,该烃的结构简式为:(CH3)3CCH=CH2,名称为3,3-二甲基-1-丁烯,与溴水反应的方程式为:(CH3)3CCH=CH2+Br2→(CH3)3CCHBrCH2Br,
故答案为:C6H12;(CH3)3CCH=CH2;3,3-二甲基-1-丁烯;(CH3)3CCH=CH2+Br2→(CH3)3CCHBrCH2Br.
点评 本题考查有机物分子式确定、限制条件同分异构体书写、有机物的命名、烯烃的性质等,难度不大,侧重对基础知识的巩固,注意掌握燃烧法利用原子守恒确定有机物分子式.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.工业上常采用生物硝化法将NH4+转化NO3-的方法处理氨氮废水,工作流程如下,下列说法错误的是( )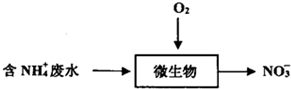

| A. | 生物硝化法处理废水,会导致水体pH逐渐下降:NH4++202=NO3-+2H++H20 | |
| B. | 长期过量使用NH4Cl等铵态化肥,易导致土壤酸化,水体富营养化 | |
| C. | 检验NH4+所需的试剂是浓NaOH溶液,湿润的蓝色石蕊试纸 | |
| D. | 微生物保持活性的pH范围为7〜9,可以加入石灰石来调节水体的pH |
11.下列变化中,吸收的热量用于克服分子间作用力的是( )
| A. | 加热金属铝使之熔化 | B. | 液态SO3受热蒸发 | ||
| C. | 加热HI气体使之分解 | D. | 加热石英晶体使之熔化 |
5.某厂利用一批回收的废料制造胆矾(CuSO4•5H2O).该废料中各种成份含量如下:Cu和CuO约占87%,其它为MgO、Cr2O3、FeO、SiO2,工艺流程为:
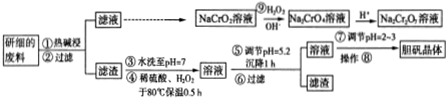
提示:25℃时,部分金属阳离子以氢氧化物形式完全沉淀(离子浓度小于等于10-5mol•L-1)时溶液的pH如下表:
回答下列问题:
(1)25℃时,Ksp[Fe(OH)3]的数值为10-38.3
(2)步骤①中Cr2O3能与碱反应,该反应的离子方程式为Cr2O3+2OH-=2CrO2-+H20
步骤④中与H2O2反应的物质和离子是Cu、Fe2+
步骤⑤中调节溶液pH时适宜的物质是bc(填序号)
a.NaOH b.CuO c.Cu(OH)2
(3)操作⑧的分离方法是蒸发浓缩、冷却结晶、过滤,这样得到的胆矾晶体中除铜元素外还含有一种金属元素,这种金属元素的氧化物的电子式为 .
.
(4)步骤⑨中氧化剂与还原剂的物质的量之比为3:2;硫酸酸化的Na2Cr2O7溶液可以将乙醇氧化为乙酸,本身还原为Cr3+,该反应可用于检测司机是否酒驾,相应的化学方程式为3CH3CH2OH+2Na2Cr2O7+8H2SO4=3CH3COOH+2Cr2(SO4)3+11H2O+2Na2SO4.

提示:25℃时,部分金属阳离子以氢氧化物形式完全沉淀(离子浓度小于等于10-5mol•L-1)时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 2.9 | 6.7 | 9.4 | 9.7 |
(1)25℃时,Ksp[Fe(OH)3]的数值为10-38.3
(2)步骤①中Cr2O3能与碱反应,该反应的离子方程式为Cr2O3+2OH-=2CrO2-+H20
步骤④中与H2O2反应的物质和离子是Cu、Fe2+
步骤⑤中调节溶液pH时适宜的物质是bc(填序号)
a.NaOH b.CuO c.Cu(OH)2
(3)操作⑧的分离方法是蒸发浓缩、冷却结晶、过滤,这样得到的胆矾晶体中除铜元素外还含有一种金属元素,这种金属元素的氧化物的电子式为
 .
.(4)步骤⑨中氧化剂与还原剂的物质的量之比为3:2;硫酸酸化的Na2Cr2O7溶液可以将乙醇氧化为乙酸,本身还原为Cr3+,该反应可用于检测司机是否酒驾,相应的化学方程式为3CH3CH2OH+2Na2Cr2O7+8H2SO4=3CH3COOH+2Cr2(SO4)3+11H2O+2Na2SO4.
6.钠离子电池具有资源广泛、价格低廉、环境友好、安全可靠的特点,特别适合于固定式大规模储能应用的需求.一种以Na2SO4水溶液为电解液的钠离子电池总反应为:NaTi2(PO4)3+2Na2NiFeⅡ (CN)6$?_{充电}^{放电}$Na3Ti2(PO4)3+2NaNiFeⅢ(CN)6(注:其中P的化合价为+5,Fe的上标II、III代表其价态).下列说法不正确的是( )
| A. | 放电时NaTi2(PO4)3在正极发生还原反应 | |
| B. | 充电过程中阳极反应式为:2NaNiFeⅢ(CN)6+2Na++2e-=2Na2NiFeⅡ (CN)6 | |
| C. | 放电时负极材料中的Na+脱离电极进入溶液,同时溶液中的Na+嵌入到正极材料中 | |
| D. | 该电池在较长时间的使用过程中电解质溶液中Na+的浓度基本保持不变 |
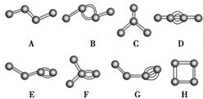 如图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合.
如图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合.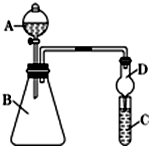 小明和同班同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
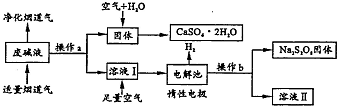
小明和同班同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验. 为了充分应用资源,用工业废碱液(Ca(OH)2、NaOH)与烟道气(回收成份SO2)来制取石膏(CaSO4•2H2O)和过二硫酸钠(Na2S2O8).设计简要流程如下:
为了充分应用资源,用工业废碱液(Ca(OH)2、NaOH)与烟道气(回收成份SO2)来制取石膏(CaSO4•2H2O)和过二硫酸钠(Na2S2O8).设计简要流程如下: