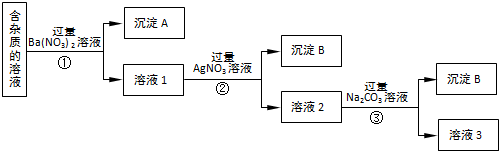
题目内容
10. 图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水.向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝.
图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水.向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝.(1)撤去A处酒精灯后铜丝仍然能保持红热的原因是因为2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O是一个放热反应,能维持反应所需温度;
(2)反应后将试管C中的液体冷却,取出少量,加入到新制的Cu(OH)2悬浊液中,加热到沸腾可观察到现象是有红色沉淀生成,写出反应的化学方程式HCHO+4Cu(OH)2$\stackrel{△}{→}$CO2↑+2Cu2O↓+5H2O.
分析 (1)根据醇的氧化反应是一个放热反应,能维持反应所需温度;
(2)生成的甲醛易溶于水,与新制的氢氧化铜在加热条件下反应生成氧化亚铜红色沉淀.
解答 解:(1)醇的氧化反应:2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O是一个放热反应,能维持反应所需温度,所以不加热的铜丝仍保持红热;
故答案为:因为2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O是一个放热反应,能维持反应所需温度;
(2)生成的甲醛易溶于水,与新制的氢氧化铜在加热条件下反应生成氧化亚铜红色沉淀,方程式为:HCHO+4Cu(OH)2$\stackrel{△}{→}$CO2↑+2Cu2O↓+5H2O;
故答案为:有红色沉淀生成;HCHO+4Cu(OH)2$\stackrel{△}{→}$CO2↑+2Cu2O↓+5H2O.
点评 本题主要考查了醇的氧化,涉及醛的性质与化学方程式的书写,难度不大,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.氢气、甲烷完全燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
将氢气、甲烷按一定比例混合,所得气体的密度是相同条件下N2的$\frac{1}{2}$,则9.8g该混合物完全燃烧能放出的热量最多为( )
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
将氢气、甲烷按一定比例混合,所得气体的密度是相同条件下N2的$\frac{1}{2}$,则9.8g该混合物完全燃烧能放出的热量最多为( )
| A. | 280.58kJ | B. | 562.76kJ | C. | 530.58kJ | D. | 890.3kJ |
5.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示:
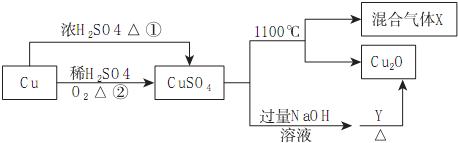
下列说法正确的是( )

下列说法正确的是( )
| A. | 途径①和途径②都体现了硫酸的酸性和氧化性 | |
| B. | Y可以是乙醛溶液 | |
| C. | CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | 将CuSO4溶液蒸发浓缩、冷却结晶,可制得胆矾晶体 |
15.标准状况下,0.1mol某烃与1molO2(过量)混和,完全燃烧后通过足量的过氧化钠固体,固体增重15克,从过氧化钠中逸出的全部气体为16.8L(标准状况),则该烃的分子式为( )
| A. | C2H4 | B. | C3H8 | C. | C4H8 | D. | C5H10 |
19.过氧化钾与水的反应类似于过氧化钠与水的反应,其化学方程式为:2K2O2+2H2O=4KOH+O2↑当0.5mol K218O2与足量H2O完全反应后,下表对生成物O2的叙述中错误的是( )
| K218O2的质量 | O2的叙述 | |
| A | 57g | O2的质量为9g |
| B | 57g | 生成标准情况下O2的体积为5.6L |
| C | 114g | O2的摩尔质量是32g•mol-1 |
| D | 57g | 生成0.25molO2 |
| A. | A | B. | B | C. | C | D. | D |
20.模型在研究物质的结构和变化有很重要的作用.如图表示乙烯(C2H4)、甲醛(HCHO)和物质甲的分子结构模型.下列叙述错误的是( )


| A. | 物质甲的分子式为C2H4O2 | |
| B. | 若物质甲具有酸性,则乙烯和甲醛一定具有酸性 | |
| C. | 物质甲、乙烯和甲醛分子都具有双键 | |
| D. | 若三种物质在空气中完全燃烧,生成的产物相同 |
 .
.
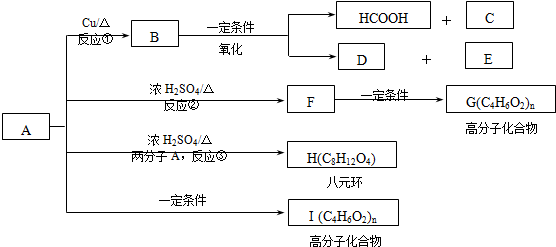
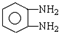 )生成一种合成纤维:
)生成一种合成纤维: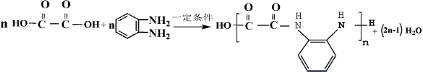 .
.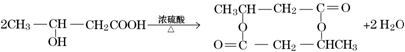 .
.