题目内容
8.水溶液X中只可能溶有Na+、K+、Mg2+、Al3-、AlO2-、SiO32-、HCO3-、CO32-、SO42-中的若干种离子.某同学对该溶液进行了如图所示实验: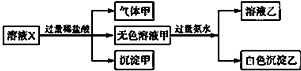
下列判断正确的是( )
| A. | K+、AlO2-和SiO32-一定存在于溶液X中 | |
| B. | HCO3-和SO42-一定不存在于溶液X中 | |
| C. | 沉淀甲是硅酸和硅酸镁的混合物 | |
| D. | 溶液中一定存在大量CO32- |
分析 能和盐酸反应获得气体的是碳酸根或是碳酸氢根离子,会生成沉淀的是硅酸根离子,碳酸根离子、碳酸氢根离子和镁离子以及铝离子不能共存于溶液中,能和过量的氨水反应生成的白色沉淀只能是氢氧化铝,偏铝酸根离子和过量的盐酸反应会生成铝离子,根据离子之间的反应以及实验现象确定存在的离子.
解答 解:加HCl有气体,说明有HCO3-、CO32-中的至少一种离子,生成的气体是二氧化碳,一定不存在与碳酸氢根、碳酸根不共存的离子,所以不存在镁离子、铝离子;加盐酸有沉淀,说明一定有硅酸根离子,硅酸是沉淀,加入过量氨水(提供OH-)有沉淀生成,只能是氢氧化铝沉淀,说明此时溶液中存在铝离子,但是原来溶液中的铝离子一定不能存在,所以该铝离子是偏铝酸根离子和盐酸反应生成的,所以,一定存在偏铝酸根离子,故肯定不存在碳酸氢根,一定存在碳酸根,肯定无镁离子,钠离子、钾离子、硫酸根不能确定.
A、根据上述推断,溶液中K+不一定存在,故A错误;
B、硫酸根离子是否存在不能确定,故B错误;
C、溶液中一定含有CO32-,则一定不含有镁离子,它们和镁离子不共存,所以沉淀甲是硅酸,不可能是硅酸镁,故C错误;
D、溶液中一定含有CO32-,故D正确.
故选D.
点评 本题涉及离子的检验和离子共存等方面的知识,注意离子的特征离子反应是解决该问题的关键所在,综合性强,难度大.

练习册系列答案
相关题目
7.下列叙述正确的是( )
| A. | 反应AlCl3+4NaOH═NaAlO2+3NaCl+2H2O,可以设计成原电池 | |
| B. | Zn和稀硫酸反应时,加入少量CuSO4溶液能加快产生H2的速率 | |
| C. | 把Fe片和Cu片放入稀硫酸中,并用导线把二者相连,观察到Cu片上产生大量气泡,说明Cu与H2SO4能发生反应而Fe被钝化 | |
| D. | Zn-Cu原电池工作过程中,溶液中H+向负极作定向移动 |
8.β-月桂烯的结构如图所示,该物质与Br2按物质的量之比为1:1加成时,所得产物有( )


| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |
3.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+,NH4+,Cl-,Ca2+,Ba2+,CO32-,SO42-,现取三份100mL该溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤干燥后,沉淀质量为2.33g.根据上述实验,以下推测正确的是( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤干燥后,沉淀质量为2.33g.根据上述实验,以下推测正确的是( )
| A. | C(SO42-)为0.1mol/L | B. | 100mL溶液中含0.01mol CO32- | ||
| C. | K+可能存在 | D. | Ba2+一定不存在,Ca2+可能存在 |
17.检验铵盐的方法是将待检物取出少量放在试管中,然后( )
| A. | 加水溶解,用红色石蕊试纸测其溶液的酸碱性 | |
| B. | 加强碱溶液后加热,滴入酚酞试液,观察溶液颜色 | |
| C. | 加热,将湿润的红色石蕊试纸放在管口观察现象 | |
| D. | 加苛性钠溶液后加热,用湿润的红色石蕊试纸放在试管口进行检验 |
18.下列说法中不正确的是( )
| A. | 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 | |
| B. | 化学能与其他形式的能相互转化的途径是化学反应 | |
| C. | 乙醇分子与水分子之间不仅存在范德华力还存在氢键 | |
| D. | 微粒半径K+<Cl?<S2? |
