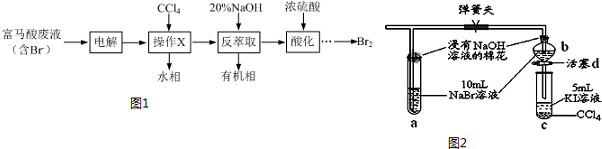
题目内容
18.下列说法中不正确的是( )| A. | 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 | |
| B. | 化学能与其他形式的能相互转化的途径是化学反应 | |
| C. | 乙醇分子与水分子之间不仅存在范德华力还存在氢键 | |
| D. | 微粒半径K+<Cl?<S2? |
分析 A.中和热是指稀的强酸溶液和稀的强碱溶液发生中和反应,生成1mol水放出的热量;
B.化学能能转化为其他形式的能;
C.乙醇分子与水分子之间存在氢键;
D.核外电子排布相同的微粒,原子序数越小,半径越大.
解答 解:A.1mol硫酸含2mol氢离子和足量强碱反应生成2mol水,因此放出的热量不是中和热,故A错误;
B.化学能能通过化学反应转化为其他形式的能,故B正确;
C.乙醇分子与水分子之间存在氢键和范德华力,故C正确;
D.由于原子序数S<Cl<K,故微粒半径:K+<Cl?<S2?,故D正确,故选A.
点评 本题考查较为综合,涉及氢键和微粒半径的比较,为高考常见题型,综合考查学生的分析能力和化学科学素养,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
8.水溶液X中只可能溶有Na+、K+、Mg2+、Al3-、AlO2-、SiO32-、HCO3-、CO32-、SO42-中的若干种离子.某同学对该溶液进行了如图所示实验:
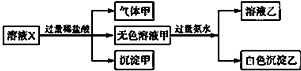
下列判断正确的是( )

下列判断正确的是( )
| A. | K+、AlO2-和SiO32-一定存在于溶液X中 | |
| B. | HCO3-和SO42-一定不存在于溶液X中 | |
| C. | 沉淀甲是硅酸和硅酸镁的混合物 | |
| D. | 溶液中一定存在大量CO32- |
6.阿伏伽德罗常数用NA表示,则下列叙述中正确的是( )
| A. | 0.1 mol Na2O2中所含的阴离子数为0.2NA | |
| B. | 常温常压下,5.6 g N2和CO混合物中所含有的原子总数为0.4 NA | |
| C. | 标准状况下,2.24 L H2O中含有的氧原子数目为0.1 NA | |
| D. | Cu和足量的浓硫酸反应产生4.48 L气体时,转移的电子数为0.4 NA |
13.下列说法中正确的是( )
| A. | 放热反应不一定不需要加热,但吸热反应一定需要加热 | |
| B. | 中和反应都是放热反应 | |
| C. | 氢气燃烧放出大量的热,说明参加反应的氢气和氧气总能量比生成物水的总能量低 | |
| D. | C与CO2反应是吸热反应 |
3. 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 反应进行到5 s时,v(A)=v(B)=v(C)=v(D) | |
| B. | 反应进行到5 s时,B的平均反应速率为0.06mol/(L•s) | |
| C. | 反应进行到1 s时,v(A)=v(B) | |
| D. | 该反应的化学方程式为6A+2D?3B+4C |
10.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在4.4~7.5范围内.
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”)

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH在4.4~7.5范围内.
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”)
7.下列气体溶于水后,不发生氧化还原反应的是( )
| A. | SO2 | B. | NO2 | C. | CO2 | D. | NH3 |
8.下列表达方式或说法正确的是( )
| A. | CO2的分子模型示意图: | B. | 某R元素原子的电子排布图: | ||
| C. | p-p π键电子云模型: | D. | 乙烯分子的球棍模型: |