题目内容
15.有0.1mol•L-1的三种溶液:①CH3COOH ②NaOH ③CH3COONa,下列说法正确的是( )| A. | 溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-) | |
| B. | 溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| C. | 溶液①、③等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+) | |
| D. | 溶液①、③等体积混合,混合液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
分析 A.溶液①、②等体积混合,二者恰好反应生成0.05mol/L的CH3COONa;
B.溶液①、②等体积混合,二者恰好反应生成0.05mol/L的CH3COONa,根据物料守恒判断;
C.溶液①、③等体积混合,CH3COOH电离程度大于CH3COO-水解程度导致溶液呈酸性,溶液中存在物料守恒,根据物料守恒判断;
D.溶液①、③等体积混合,CH3COOH电离程度大于CH3COO-水解程度导致溶液呈酸性,但CH3COOH电离程度较小.
解答 解:A.溶液①、②等体积混合,二者恰好反应生成0.05mol/L的CH3COONa,两种溶液中醋酸根离子都水解但水解程度较小,所以混合液中c(CH3COO-)小于溶液③中的c(CH3COO-),故A错误;
B.溶液①、②等体积混合,二者恰好反应生成0.05mol/L的CH3COONa,混合溶液体积是原来①或②的2倍,所以浓度是原来的一半,根据物料守恒得c(CH3COO-)+c(CH3COOH)=0.05mol/L,故B错误;
C.溶液①、③等体积混合,CH3COOH电离程度大于CH3COO-水解程度导致溶液呈酸性,溶液中存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=2c(Na+),故C错误;
D.溶液①、③等体积混合,CH3COOH电离程度大于CH3COO-水解程度导致溶液呈酸性,但CH3COOH电离程度较小,所以c(CH3COO-)>0.05mol/L、c(Na+)=0.05mol/L、c(CH3COOH)<0.05mol/L但大于c(H+),则离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故D正确;
故选D.
点评 本题考查离子浓度大小比较,为高频考点,明确混合溶液中溶质成分及其性质是解本题关键,侧重考查学生分析判断能力,注意:溶液等体积混合后溶液浓度的变化,为易错点.

 实验室模拟SO2与O2在一定条件下反应生成SO3.现将1.00mol SO2与1.00mol O2置于一体积不变的1L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-l.在其他条件不变的情况下,不同温度时SO3的浓度(mol•L-1)随时间(min)的变化如表格所示:
实验室模拟SO2与O2在一定条件下反应生成SO3.现将1.00mol SO2与1.00mol O2置于一体积不变的1L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-l.在其他条件不变的情况下,不同温度时SO3的浓度(mol•L-1)随时间(min)的变化如表格所示:  | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| T1 | 0 | 0.20 | 0.30 | 0.39 | 0.47 | 0.50 | 0.50 |
| T2 | 0 | 0.25 | 0.40 | 0.40 | 0.40 | 0.40 | 0.40 |
(2)T1温度下,0~10min内化学反应速率v(O2)=0.015mol•L-1•min-1,T2温度下的化学平衡常数K=0.56(不写单位).
(3)下列有关该反应的说法正确的是D.
A.T1温度时,反应在10min时的混合气体密度是30min时密度的0.6倍
B.T1温度时,反应在10min时的混合气体的平均相对分子质量与30min时相等
C.T2温度时,当c(SO2)=c(SO3)时达到化学平衡状态
D.T1、T2温度下分别达到化学平衡状态时,T1温度下压强小
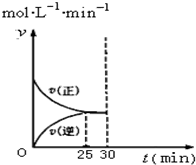
(4)如图是在T1温度下的v-t图象.在T1温度下30min时将容器的体积缩小至0.5L,请在图象中画出在T1温度下重新达到平衡的图象(正反应速率和逆反应速率分别表示为v正′和v逆′).
| A. | 硫酸与氢氧化钡溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 碳酸氢钠与盐酸反应:CO32-+2 H+═CO2↑+H2O | |
| C. | 硫酸镁溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 少量CO2通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O |
表一:原料、反应条件、平衡转化率、日产量
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{催化剂/△}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
(1)从产率和产量角度分析虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多.
(2)从环境保护和能耗角度分析两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;乙炔的制取要经过多步反应制得,且消耗大量的热能、电能;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得.
| A. | TiCl4溶于大量水加热制备TiO2 | |
| B. | FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 | |
| C. | 配制氯化亚铁溶液时需加少量铁粉 | |
| D. | 将氯化铝溶液加热蒸干并灼烧,最后得到的固体是氧化铝 |
| A. | ${\;}_{6}^{14}$C的中子数是8 | |
| B. | ${\;}_{6}^{14}$C与${\;}_{6}^{12}$C互为同位素 | |
| C. | ${\;}_{6}^{14}$C转化为${\;}_{6}^{12}$C不是化学变化 | |
| D. | ${\;}_{6}^{14}$C与${\;}_{6}^{12}$C互为同素异形体 |
 葡萄可用于酿酒.
葡萄可用于酿酒.(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是产生砖红色沉淀.
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的化学方程式C6H12O6(葡萄糖)$\stackrel{酒化酶}{→}$2CO2↑+2C2H5OH.
(3)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备.实验室用如图所示装置制备乙酸乙酯:
①试管a中生成乙酸乙酯的化学方程式是CH3COOH+C2H5OH
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.②试管b中盛放的试剂是饱和Na2CO3溶液.
③实验开始时,试管b中的导管不伸入液面下的原因是防止溶液倒吸.
(4)有机物E由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的E为无色粘稠液体,易溶于水.为研究E的组成与结构,进行了如下实验:
| ①称取E4.5g,升温使其汽化,测其密度是相同条件下H2的45倍. | ①有机物E的相对分子量为90: |
| ②将此9.0gE在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况). | ②9.0g有机物E完全燃烧时,经计算:生成CO2共为0.3 mol, 生成的H2O5.4g. 有机物E的分子式C3H6O3 |
| ③经红外光谱测定,证实其中含有羟基,羧基,甲基; | ③E的结构简式CH3CH(OH)COOH |
⑤写出E与NaHCO3溶液反应的化学方程式HOOC-CH(OH)-CH3+NaHCO3→NaOOC-CH(OH)-CH3+H2O+CO2↑.
| A. | 有机物在滤液中 | B. | 杂质在滤液中 | C. | 有机物滤纸上 | D. | 杂质在溶剂中 |