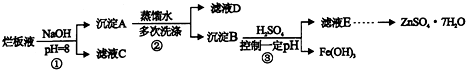
题目内容
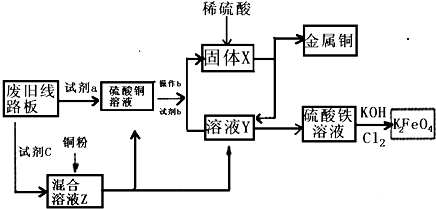 根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4).据此回答问题:
根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4).据此回答问题:(1)试剂a最好为
A.浓硫酸 B.硫酸铁溶液 C.氯水 D.H2 O2和稀硫酸 E.Fe
(2)溶液Z中金属离子可能有Cu2+、Fe2+、Fe3+,检验Fe3+的试剂为
(3)溶液Y的水溶液显
(4)K2FeO4是强氧化剂,目前水处理通常用K2FeO4理由是
(5)室温时向Fe2(SO4)3溶液中滴加NaOH溶液,若要使Fe3+完全沉淀,则所需溶液的pH值至少为
考点:金属的回收与环境、资源保护
专题:实验设计题
分析:(1)试剂a要满足可以把铜单质氧化生成硫酸铜、不引入关键杂质离子(例如Fe2+、Fe3+)且不污染环境等条件.由已知终端产物金属铜和硫酸铁溶液反推可知固体X和溶液Y,从而确定试剂b;
(2)由CuSO4溶液和溶液Y(FeSO4溶液)可知试剂c为硫酸铁溶液,KMnO4溶液可腐蚀橡胶;滴定管中,滴定终点时的现象是滴加最后一滴KMnO4,溶液变为浅紫色;
(3)溶液Y为FeSO4溶液,强酸弱碱盐溶液水解呈酸性;
(4)K2FeO4除与水反应生成4Fe(OH)3(胶体)之外,还具有强氧化性,生成K2FeO4的离子方程式2Fe3++2Cl2+16OH-=2 FeO42-+16Cl-+8 H2O;
(5)依据Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38 计算氢氧根离子浓度,结合离子积常数计算氢离子浓度计算PH;
(2)由CuSO4溶液和溶液Y(FeSO4溶液)可知试剂c为硫酸铁溶液,KMnO4溶液可腐蚀橡胶;滴定管中,滴定终点时的现象是滴加最后一滴KMnO4,溶液变为浅紫色;
(3)溶液Y为FeSO4溶液,强酸弱碱盐溶液水解呈酸性;
(4)K2FeO4除与水反应生成4Fe(OH)3(胶体)之外,还具有强氧化性,生成K2FeO4的离子方程式2Fe3++2Cl2+16OH-=2 FeO42-+16Cl-+8 H2O;
(5)依据Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38 计算氢氧根离子浓度,结合离子积常数计算氢离子浓度计算PH;
解答:
解:(1)试剂a要满足可以把铜单质氧化生成硫酸铜、不引入关键杂质离子(例如Fe2+、Fe3+)且不污染环境等条件,废旧电路板与试剂a反应能够生成硫酸铜溶液的有A、B、D三种试剂,但A浓硫酸与铜反应就需要加热,而且反应还会产生SO2污染空气,B硫酸铁溶液与铜反应会产生Fe2+、Fe3+杂质离子;由已知硫酸铁溶液反推可知溶液Y为FeSO4溶液,由CuSO4溶液与试剂b反应生成FeSO4溶液和固体X不难推出试剂b为Fe,固体X为铜和过量铁粉,
故答案为:D;E;
(2)Fe3+与SCN-反应生成红色的Fe(SCN)3,通常用KSCN溶液来检验Fe3+;一定物质的量浓度溶液的配制实验用到的主要仪器就是容量瓶,KMnO4溶液具有强氧化性,可腐蚀橡胶管,所以强氧化性及酸性溶液应加入酸式滴定管,滴定终点时的现象是滴加最后一滴KMnO4,溶液变为浅紫色;
故答案为:KSCN;容量瓶;酸式;滴加最后一滴KMnO4,溶液变为浅紫色;
(3)溶液Y为FeSO4溶液,强酸弱碱盐溶液水解呈酸性,水解方程式为:Fe2++2H2O≒Fe(OH)2+2H+,故答案为:酸;Fe2++2H2O≒Fe(OH)2+2H+;
(4)FeCl3净水是由于Fe3+生成Fe(OH)3胶体,Fe(OH)3胶体能吸附水中的悬浮物而达到净水目的,K2FeO4除与水反应生成Fe(OH)3(胶体)之外,还具有强氧化性,可以杀菌消毒,生成K2FeO4的离子方程式2Fe3++3Cl2+16OH-=2 FeO42-+6Cl-+8 H2O,故答案为:高铁酸钾(K2FeO4)具有强氧化性,能杀菌消毒,同时生成的Fe3+ 能水解得到Fe(OH)3胶体,具有净水的功能;2Fe3++3Cl2+16OH-=2 FeO42-+6Cl-+8 H2O;
(5)Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38 当溶液中的Fe3+完全沉淀,此时溶液中的Fe3+物质的量的浓度=10-5mol/L,c(Fe3+).c3(OH-)=1.0×10-38;c3(OH-)=10-33,c(OH-)=10-11mol/L,c(H+)=10-3mol/L,PH=3;故答案为:3.
故答案为:D;E;
(2)Fe3+与SCN-反应生成红色的Fe(SCN)3,通常用KSCN溶液来检验Fe3+;一定物质的量浓度溶液的配制实验用到的主要仪器就是容量瓶,KMnO4溶液具有强氧化性,可腐蚀橡胶管,所以强氧化性及酸性溶液应加入酸式滴定管,滴定终点时的现象是滴加最后一滴KMnO4,溶液变为浅紫色;
故答案为:KSCN;容量瓶;酸式;滴加最后一滴KMnO4,溶液变为浅紫色;
(3)溶液Y为FeSO4溶液,强酸弱碱盐溶液水解呈酸性,水解方程式为:Fe2++2H2O≒Fe(OH)2+2H+,故答案为:酸;Fe2++2H2O≒Fe(OH)2+2H+;
(4)FeCl3净水是由于Fe3+生成Fe(OH)3胶体,Fe(OH)3胶体能吸附水中的悬浮物而达到净水目的,K2FeO4除与水反应生成Fe(OH)3(胶体)之外,还具有强氧化性,可以杀菌消毒,生成K2FeO4的离子方程式2Fe3++3Cl2+16OH-=2 FeO42-+6Cl-+8 H2O,故答案为:高铁酸钾(K2FeO4)具有强氧化性,能杀菌消毒,同时生成的Fe3+ 能水解得到Fe(OH)3胶体,具有净水的功能;2Fe3++3Cl2+16OH-=2 FeO42-+6Cl-+8 H2O;
(5)Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38 当溶液中的Fe3+完全沉淀,此时溶液中的Fe3+物质的量的浓度=10-5mol/L,c(Fe3+).c3(OH-)=1.0×10-38;c3(OH-)=10-33,c(OH-)=10-11mol/L,c(H+)=10-3mol/L,PH=3;故答案为:3.
点评:本题考查铜、铁及其重要化合物、Fe3+检验、容量瓶滴定管的使用、净水原理、转移电子的计算、电极反应式的书写等知识,考查综合全面,熟知铜、铁单质及其离子的转化是解题关键,转移电子的计算和正极电极反应式的书写是难点.

练习册系列答案
相关题目
已知:
①NH3(g)+HCl(g)═NH4Cl(s)△H1=-176kJ/mol
②NH3(g)=NH3(aq)△H2=-35.1kJ/mol
③HCl(g)=HCl(aq)△H3=-72.3kJ/mol
④NH3(aq)+HCl(aq)═NH4Cl(aq)△H4=-52.3kJ/mol
则反应NH4Cl(s)=NH4Cl(aq)的△H5为( )
①NH3(g)+HCl(g)═NH4Cl(s)△H1=-176kJ/mol
②NH3(g)=NH3(aq)△H2=-35.1kJ/mol
③HCl(g)=HCl(aq)△H3=-72.3kJ/mol
④NH3(aq)+HCl(aq)═NH4Cl(aq)△H4=-52.3kJ/mol
则反应NH4Cl(s)=NH4Cl(aq)的△H5为( )
| A、+16.3 kJ/mol |
| B、-16.3 kJ/mol |
| C、+335.7 kJ/mol |
| D、-335.7 kJ/mol |
下列实验操作先后顺序正确的是( )
| A、先装好药品,后检查装置的气密性 |
| B、先用双手握紧试管,后将导管插入水中以检查装置的气密性 |
| C、开始氢气还原氧化铜的实验时,先通入一段时间的氢气,再加热 |
| D、稀释硫酸时,先在烧杯里倒入水,再小心例入浓硫酸并不断搅拌 |
为海底作业提供氧气的物质是( )
| A、KClO3 |
| B、KMnO4 |
| C、Na2O2 |
| D、H2O |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、1.0mol?L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- | ||
B、
| ||
| C、pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- | ||
| D、c(ClO-)=1.0 mol?L-1的溶液:Na+、SO32-、S2-、SO42- | ||
| E、与铝反应产生H2的溶液中:NO3-、Na+、Cl-、K+ |
有如下三个热化学方程式:
H2(g)+
O2(g)═H2O(g)△H=a kJ?mol-1
H2(g)+
O2(g)═H2O(l)△H=b kJ?mol-1
2H2(g)+O2(g)═2H2O(l)△H=c kJ?mol-1
关于它们的下列表述正确的是( )
H2(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
2H2(g)+O2(g)═2H2O(l)△H=c kJ?mol-1
关于它们的下列表述正确的是( )
| A、它们都是吸热反应 |
| B、a、b和c均为正值 |
| C、a<b |
| D、2b=c |