题目内容
(1)常温下,有pH为12的NaOH溶液10mL,若将溶液分成两等份,其中一份加入水,另一份加入pH=10的NaOH溶液,最终均将其溶液的pH变为11,则加入水与NaOH溶液的体积比为 .
(2)若向10mLpH为12的NaOH溶液中加入pH=2的任意一元酸HR溶液VmL,最终也将溶液的pH变为11,则V的取值范围是 .(设溶液的体积可以直接相加;计算结果保留到小数点后一位)
(2)若向10mLpH为12的NaOH溶液中加入pH=2的任意一元酸HR溶液VmL,最终也将溶液的pH变为11,则V的取值范围是
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)先根据溶液的pH计算氢氧根离子浓度,再根据c1V1=c2(V1+V2)计算加入的水体积;根据溶液的pH计算氢氧根离子浓度,再根据c1V1+c2V2=c3(V1+V2)计算加入的氢氧化钠溶液体积;
(2)先计算混合溶液中氢氧根离子浓度,再根据C(OH-)=
;假设为强酸,计算需要加入酸的体积,若是弱酸,加入的体积应该稍微小于此值.
(2)先计算混合溶液中氢氧根离子浓度,再根据C(OH-)=
| n(碱)-n(酸) |
| V(碱)+V(酸) |
解答:
解:(1)pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,设加入水的体积是V2,c1V1=c2(V1+V2),0.01mol/L×0.01L=0.001mol/L(0.01+V2)L,V2=0.09L=90mL,
pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,pH=10的氢氧化钠溶液中氢氧根离子浓度是0.0001mol/L,
设加入pH=10的NaOH溶液体积是V2,
c1V1+c2V2=c3(V1+V2),0.01mol/L×0.01L+0.0001mol/L×V2=0.001mol/L(0.01+V2),
V2=0.1L=100mL,则加入水与NaOH溶液的体积比=90:100=9:10;
故答案为:9:10;
(2)假设加入一元酸HR是强酸,pH=2的HR溶液中氢离子浓度是0.01mol/L,设加入HR的体积是V,C(OH-)=
=
=0.001mol/L,v=0.0082L=8.2ml,
加入的酸是强酸应该是V=8.2mL,若HR为弱酸,加入8.2 mL后溶液pH<11,故加入的HR应小于8.2 mL而大于0,
故答案为:0<V≤8.2 mL.
pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,pH=10的氢氧化钠溶液中氢氧根离子浓度是0.0001mol/L,
设加入pH=10的NaOH溶液体积是V2,
c1V1+c2V2=c3(V1+V2),0.01mol/L×0.01L+0.0001mol/L×V2=0.001mol/L(0.01+V2),
V2=0.1L=100mL,则加入水与NaOH溶液的体积比=90:100=9:10;
故答案为:9:10;
(2)假设加入一元酸HR是强酸,pH=2的HR溶液中氢离子浓度是0.01mol/L,设加入HR的体积是V,C(OH-)=
| n(碱)-n(酸) |
| V(碱)+V(酸) |
| 0.01mol/L×0.01L-0.01mol/L×VL |
| 0.01L+VL |
加入的酸是强酸应该是V=8.2mL,若HR为弱酸,加入8.2 mL后溶液pH<11,故加入的HR应小于8.2 mL而大于0,
故答案为:0<V≤8.2 mL.
点评:本题考查溶液pH的简单计算,沉淀溶解平衡中溶度积计算,难点(2)题计算酸溶液的体积,利用假设法进行分析解答即可,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
CH4分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是( )
| A、CH3Cl不存在同分异构现象 |
| B、CH2Cl2不存在同分异构现象 |
| C、CHCl3不存在同分异构现象 |
| D、CH4是气体分子 |
在 分子中最多可能有多少个原子共处于同一平面( )
分子中最多可能有多少个原子共处于同一平面( )
 分子中最多可能有多少个原子共处于同一平面( )
分子中最多可能有多少个原子共处于同一平面( )| A、18 | B、19 | C、20 | D、21 |
化学已经渗透到人类生活的各个方面,下列说法不正确的是( )
| A、日本福岛核电站泄露的放射性物质131I和127I互为同位素,化学性质几乎相同 |
| B、“光化学烟雾”、“硝酸酸雨”的形成都与氮氧化合物有关 |
| C、汽油中添加Pb(C2H5)4,提高汽油的抗爆震性能,有利于改善大气环境 |
| D、低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
农药波尔多液不能用铁制容器盛放,是因铁能与该农药中的硫酸铜起反应.在该反应中,铁是( )
| A、氧化剂 | B、还原剂 |
| C、催化剂 | D、漂白剂 |
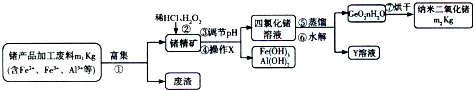
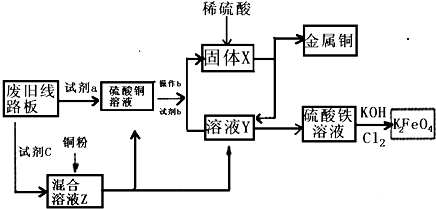 根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4).据此回答问题:
根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4).据此回答问题: