题目内容
14.在碘化钾和硫酸的混合溶液中加入过氧化氢水溶液,迅速发生反应,放出大量气体,反应过程表示如下:①H2O2+2KI+H2SO4═I2+K2SO4+2H2O;
②H2O2+I2═2HIO;
③H2O2+2HIO═I2+O2↑+2H2O.
下列有关该反应的说法正确的是( )
| A. | 反应速率与SO42-浓度有关 | |
| B. | 催化剂能加快化学反应速率,但反应物所需活化能不变 | |
| C. | 碘单质是过氧化氢分解的催化剂 | |
| D. | 与一定量H2O2反应的KI溶液浓度越大,反应速率越慢 |
分析 A.在反应①中SO42-不参与反应;
B.催化剂能降低反应物的活化能;
C.碘在反应②中是反应物、③中是生成物;
D.碘是催化剂,且碘浓度与KI浓度成正比.
解答 解:A.在反应①中SO42-不参与反应,所以硫酸根离子浓度大小不影响反应速率,故A错误;
B.催化剂能降低反应物的活化能,增大活化分子百分数,加快化学反应速率,故B错误;
C.碘在反应②中是反应物、③中是生成物,所以碘在过氧化氢的分解中作催化剂,故C正确;
D.碘是催化剂,且碘浓度与KI浓度成正比,所以与一定量双氧水反应的KI溶液浓度越大,反应速率越快,故D错误;
故选C.
点评 本题考查化学反应速率影响因素,为高频考点,侧重考查学生分析判断能力,明确该反应实质、反应速率影响原理是解本题关键,易错选项是A,题目难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
11.汽车尾气中CO、NOx 以及燃煤废弃中的SO2都是大气污染物,对它们的治理具有重要意义.吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图1(Ce为铈元素):
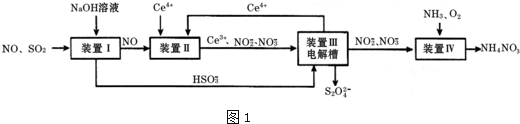
(1)装置Ⅰ中,NaOH溶液吸收SO2也可生成Na2SO3和NaHSO3的混合溶液
①写出NaOH溶液吸收SO2生成等物质的量的Na2SO3和NaHSO3混合溶液时总反应的离子方程式2SO2+3OH-=HSO3-+SO32-+H2O
②已知混合液pH随n(SO32-):n(HSO3-)变化关系如表:
当混合液中n(SO32-):n(HSO3-)=1:1时,c(Na+)>c(HSO3-)+2c(SO32-)(填“>”“=”或“<”)
(2)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出只生成NO2-的离子方程式NO+2H2O+3Ce4+=3Ce3++NO3-+4H+
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示.

①生成的Ce4+从电解槽的a(填字母序号)口流出;
②生成S2O42-的电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O;
(4)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g•L-1,要使1m3该溶液中的NO2-完全转化为NO3-,至少需向装置Ⅳ中通入标准状况下的O2$\frac{5600a}{23}$ L.(用含a代数式表示)

(1)装置Ⅰ中,NaOH溶液吸收SO2也可生成Na2SO3和NaHSO3的混合溶液
①写出NaOH溶液吸收SO2生成等物质的量的Na2SO3和NaHSO3混合溶液时总反应的离子方程式2SO2+3OH-=HSO3-+SO32-+H2O
②已知混合液pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
(2)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出只生成NO2-的离子方程式NO+2H2O+3Ce4+=3Ce3++NO3-+4H+
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示.

①生成的Ce4+从电解槽的a(填字母序号)口流出;
②生成S2O42-的电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O;
(4)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g•L-1,要使1m3该溶液中的NO2-完全转化为NO3-,至少需向装置Ⅳ中通入标准状况下的O2$\frac{5600a}{23}$ L.(用含a代数式表示)
5.下列的各组离子在酸性溶液中能大量共存的是( )
| A. | Ca2+、K+、Cl-、NO3- | B. | Na+、Ba2+、SO32-、ClO- | ||
| C. | Fe2+、K+、SO42-、NO3- | D. | Na+、Fe3+、S2-、Cl- |
9.同温同压下,用等质量的CH4、CO2、H2S、HCl四种气体分别吹出四个气球,其中气球体积最小的是( )
| A. | CH4 | B. | CO2 | C. | H2S | D. | HCl |
6.下列有关叙述中,正确的是( )
| A. | 次氯酸的电子式为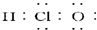 | |
| B. | 将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl | |
| C. | 将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 | |
| D. | 氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气 |
3.下列推断正确的是( )
| A. | SiO2、NO2都能与NaOH溶液反应,都是酸性氧化物 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | 为增大氯水中c(HClO),应采取的措施是加入CaCO3固体 | |
| D. | 铁、铝容器常温下可盛放浓硫酸,是因为常温下铁、铝与浓硫酸不反应 |
4.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1 mol甲醇中含有C-H键的数目为4NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| D. | 1mol丙烯酸中含有双键的数目为NA |
 .
.
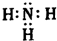 .化合物X的电子式
.化合物X的电子式 .
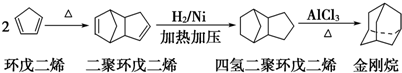
.
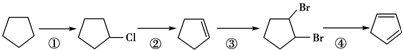
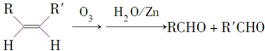 ,请写出下列反应产物的结构简式:
,请写出下列反应产物的结构简式: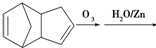
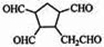 .
.