题目内容
1.设NA代表阿伏伽德罗常数,下列说法正确的是( )①22.4L氦气含有的核外电子总数为2NA
②17g羟基所含的中子数为8NA
③56g的铁发生氧化还原反应,一定失去3NA个电子
④100mL0.5mol/L的甲酸溶液中,甲酸的分子数目小于0.05NA
⑤标准状况下,22.4LCH3OH中含有的氢原子数为4NA
⑥常温常压,22.4LNO气体的分子数小于NA.
| A. | ①②⑤ | B. | ③④⑤ | C. | ②④⑥ | D. | ③⑤⑥ |
分析 ①22.4L氦气温度压强不知,物质的量不是1mol;
②1mol羟基(-16OH)含8mol中子;
③铁参与的氧化还原反应,生成产物中铁元素化合价由+2、+3价,产物中铁元素的化合价不知,转移的电子数无法计算;
④甲酸是电解质,溶液中部分电离,分子数减少;
⑤标准状况下甲醇不是气体;
⑥常温常压,22.4LNO气体物质的量不是1mol,通常情况下,气体摩尔体积大于22.4L/mol,根据气体的物质的量计算其含有的分子数.
解答 解:①22.4L氦气温度压强不知,物质的量不是1mol,不能计算微粒数,故①错误;
②1mol羟基(-16OH)含8mol中子,即8NA个,故②正确;
③56g铁的物质的量为1mol,1mol铁完全反应失去的电子可能为2mol或3mol,所以失去的电子数不一定为3NA个,故③错误;
④甲酸是弱电解质,溶液中部分电离,甲酸分子数减少,100mL 0.5mol•L-1的甲酸溶液中,甲酸的分子数目小于0.05NA,故④正确;
⑤标准状况下甲醇不是气体,22.4LCH3OH物质的量不是1mol,含有的氢原子数不是4NA,故⑤错误;
⑥常温常压,22.4LNO气体物质的量不是1mol,通常情况下,气体摩尔体积大于22.4L/mol,所以22.4LNO气体的物质的量小于1mol,含有的分子数小于NA,故⑥正确,
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,根据分子的构成、气体摩尔体积的应用条件、弱电解质电离平衡、氧化还原反应电子转移等知识来解答,为易错题,题目难度中等.

练习册系列答案
相关题目
18.下列实验操作过程中,最终不一定得到沉淀物的是( )
| A. | 混合碳酸氢钙与氢氧化钠溶液 | B. | 混合硫酸铝与氢氧化钠溶液 | ||
| C. | 混合浓氨水和硫酸铝溶液 | D. | 混合盐酸和硝酸银溶液 |
9.同温同压下,用等质量的CH4、CO2、H2S、HCl四种气体分别吹出四个气球,其中气球体积最小的是( )
| A. | CH4 | B. | CO2 | C. | H2S | D. | HCl |
16.煤化工中两个重要反应为①C(s)+H2O(g)?H2(g)+CO(g)
△H=+131.3kJ•mol-1,②CO(g)+H2O(g)$?_{△}^{催化剂}$CO2(g)+H2(g).
(1)下列说法正确的是A.
A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度
B.反应②的熵变△S>0
C.反应①中增加C固体的量能增大反应速率
D.在反应②中及时分离出产生的H2对正反应速率无影响
(2)若工业上要增加反应①的速率,最经济的措施为粉碎煤炭、增加H2O(g)的浓度、使用合适的催化剂.
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如下三组数据:
①实验Ⅰ中,从反应开始到反应达到平衡时,H2O(g)的平均反应速率为0.16mol•L-1•min-1.
②CO(g)和H2O(g)反应的△H小于0(填“大于”“小于”或“等于”).
③实验Ⅲ中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b,与实验Ⅱ相比,化学平衡常数不变(填“增大”“减小”或“不变”).
④若在900℃时,实验Ⅱ反应达到平衡后,向此容器中再加入1mol CO、0.5mol H2O、0.2mol CO2、0.5mol H2,平衡正反应方向移动(填“向正反应方向移动”“向逆反应方向移动”“不移动”).
(4)CO、H2可用于生产甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-mkJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-nkJ•mol-1
反应③:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H<0
则m与n的关系为n>2m.
△H=+131.3kJ•mol-1,②CO(g)+H2O(g)$?_{△}^{催化剂}$CO2(g)+H2(g).
(1)下列说法正确的是A.
A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度
B.反应②的熵变△S>0
C.反应①中增加C固体的量能增大反应速率
D.在反应②中及时分离出产生的H2对正反应速率无影响
(2)若工业上要增加反应①的速率,最经济的措施为粉碎煤炭、增加H2O(g)的浓度、使用合适的催化剂.
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如下三组数据:
| 实验 组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| Ⅰ | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| Ⅲ | 900 | a | b | c | d | t |
②CO(g)和H2O(g)反应的△H小于0(填“大于”“小于”或“等于”).
③实验Ⅲ中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b,与实验Ⅱ相比,化学平衡常数不变(填“增大”“减小”或“不变”).
④若在900℃时,实验Ⅱ反应达到平衡后,向此容器中再加入1mol CO、0.5mol H2O、0.2mol CO2、0.5mol H2,平衡正反应方向移动(填“向正反应方向移动”“向逆反应方向移动”“不移动”).
(4)CO、H2可用于生产甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-mkJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-nkJ•mol-1
反应③:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H<0
则m与n的关系为n>2m.
6.下列有关叙述中,正确的是( )
| A. | 次氯酸的电子式为 | |
| B. | 将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl | |
| C. | 将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 | |
| D. | 氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气 |
13.用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 标准状况下,1 mol SO3的体积约为22.4L | |
| B. | 1 mol钠原子中含有的电子数为NA | |
| C. | 常温常压下,17g NH3含氢原子数目为3NA | |
| D. | 1molFe与足量的氯气反应时,转移的电子数是2NA |
10.乙醇分子结构式如图所示,下列反应及断键部位正确的是( )


| A. | 乙醇与钠的反应是⑤键断裂 | B. | 乙醇的催化氧化反应是②③键断裂 | ||
| C. | 乙醇与乙酸发生的反应是②键断裂 | D. | 乙醇完全燃烧是①②③④⑤键断裂 |
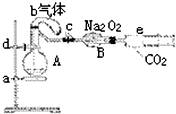 如图所示装置中,a是盛有标况下224mL空气(氧气占五分之一)和10mL 1.2mol/L硝酸的烧瓶,b是未充气(实验开始前内部没有气体)装有0.384g铜粉的气球,c是夹紧了的弹簧夹,d中盛有足量的过氧化钠,e是充有二氧化碳的注射器.整套装置经过气密性检查已合格.
如图所示装置中,a是盛有标况下224mL空气(氧气占五分之一)和10mL 1.2mol/L硝酸的烧瓶,b是未充气(实验开始前内部没有气体)装有0.384g铜粉的气球,c是夹紧了的弹簧夹,d中盛有足量的过氧化钠,e是充有二氧化碳的注射器.整套装置经过气密性检查已合格.