题目内容
18.下列关于化学反应速率的叙述不正确的是( )| A. | 食物放在冰箱中会减慢变质的速率 | |
| B. | 实验室制备CO2时,可通过增加石灰石的用量来加快反应速率 | |
| C. | 工业合成中使用适当的催化剂为了加快反应速率 | |
| D. | 实验室用锌和稀硫酸制取H2时,常滴加少量硫酸铜溶液加快反应的速率 |
分析 A、根据温度对化学反应速率的影响;
B、增加固体的量,反应速率不变;
C、根据催化剂可加快反应的速率判断;
D、构成原电池加快化学反应速率.
解答 解:A、温度降低,化学反应速率减慢,所以食物放在冰箱中会减慢食物变质的速率,故A正确;
B、因增加固体的量,反应速率不变,所以增加石灰石的用量不能来加快反应速率,故B错误;
C、因催化剂可加快反应的速率,所以工业合成中使用适当的催化剂为了加快反应速率,故C正确;
D、构成原电池加快化学反应速率,常滴加少量硫酸铜溶液形成若干微小的锌铜原电池,加快反应的速率,故D正确;
故选:B.
点评 本题主要考查了决定化学反应速率的因素和影响化学反应速率因素,难度不大.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
15.具有下列特点的物质中,属于纯净物的是( )
| A. | 由同种元素组成 | B. | 不能发生分解反应 | ||
| C. | 具有固定的熔沸点 | D. | 物质能溶于水 |
9.同温同压下,用等质量的CH4、CO2、H2S、HCl四种气体分别吹出四个气球,其中气球体积最小的是( )
| A. | CH4 | B. | CO2 | C. | H2S | D. | HCl |
6.下列有关叙述中,正确的是( )
| A. | 次氯酸的电子式为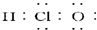 | |
| B. | 将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl | |
| C. | 将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 | |
| D. | 氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气 |
13.用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 标准状况下,1 mol SO3的体积约为22.4L | |
| B. | 1 mol钠原子中含有的电子数为NA | |
| C. | 常温常压下,17g NH3含氢原子数目为3NA | |
| D. | 1molFe与足量的氯气反应时,转移的电子数是2NA |
3.下列推断正确的是( )
| A. | SiO2、NO2都能与NaOH溶液反应,都是酸性氧化物 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | 为增大氯水中c(HClO),应采取的措施是加入CaCO3固体 | |
| D. | 铁、铝容器常温下可盛放浓硫酸,是因为常温下铁、铝与浓硫酸不反应 |
10.乙醇分子结构式如图所示,下列反应及断键部位正确的是( )
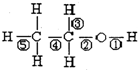

| A. | 乙醇与钠的反应是⑤键断裂 | B. | 乙醇的催化氧化反应是②③键断裂 | ||
| C. | 乙醇与乙酸发生的反应是②键断裂 | D. | 乙醇完全燃烧是①②③④⑤键断裂 |
7.将ag纯铜片投入足量的一定浓度的硝酸溶液中,反应中消耗的HNO3为bg.若a:b=8:21,则反应中起酸性作用的硝酸的质量为( )
| A. | $\frac{b}{2}$ g | B. | 2b g | C. | $\frac{3}{4}$a g | D. | $\frac{3}{4}$b g |
8.下列说法正确的是( )
| A. | 丙烷的比例模型是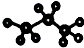 | |
| B. | C2H4与C3H6一定互为同系物 | |
| C. | 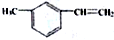 属于芳香烃 属于芳香烃 | |
| D. | 羟基的电子式为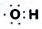 ,1mol-OH含有7mol电子 ,1mol-OH含有7mol电子 |