题目内容
向FeCl3和CuCl2混合液中加入过量的铁粉,反应完毕后,剩下的固体物质恰好跟加入的铁粉质量相等,则原混合液中FeCl3和CuCl2物质的量之比为( )
| A、2:7 | B、7:2 |
| C、1:7 | D、7:1 |
考点:有关混合物反应的计算
专题:计算题
分析:在氯化铁和氯化铜的混合溶液中加入过量的铁粉,分别发生反应:2Fe3++Fe=3Fe2+,Fe+Cu2+=Fe2++Cu,搅拌使其充分反应,所得固体残渣的质量与原铁粉的质量恰好相等,则消耗的铁的质量应等于生成的铜的质量,以此进行解答.
解答:
解:设混合物中含有xmolFeCl3,ymolCuCl2,
在FeCl3和氯CuCl2的混合溶液中加入过量的铁粉,反应的离子方程式为:2Fe3++Fe=3Fe2+,Fe+Cu2+=Fe2++Cu,
充分反应后,所得固体残渣的质量与原铁粉的质量恰好相等,则消耗的铁的质量应等于生成的铜的质量,
则:(0.5x+y)×56=64y,
整理可得 x:y=8:28=2:7,
故选A.
在FeCl3和氯CuCl2的混合溶液中加入过量的铁粉,反应的离子方程式为:2Fe3++Fe=3Fe2+,Fe+Cu2+=Fe2++Cu,
充分反应后,所得固体残渣的质量与原铁粉的质量恰好相等,则消耗的铁的质量应等于生成的铜的质量,
则:(0.5x+y)×56=64y,
整理可得 x:y=8:28=2:7,
故选A.
点评:本题考查混合物的计算,注意把握铁与氯化铁和氯化铜反应的方程式的书写,根据质量关系结合方程式计算,题目难度不大.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
已知A、B为单质,C为化合物.能实现上述转化关系的是( )
A+B
C
A+B
①符合上述转化关系的C溶于水不可能得到强碱溶液
②若C的溶液遇Na2CO3,放出CO2气体,则A可能是H2
③若A为光亮红色金属,则B可能为S
④若C的溶液中滴加铁氰化钾溶液有蓝色沉淀生成,则B可能为Cl2.
A+B
| 点燃 |
| 溶于水 |
| 惰性电极电解 |
①符合上述转化关系的C溶于水不可能得到强碱溶液
②若C的溶液遇Na2CO3,放出CO2气体,则A可能是H2
③若A为光亮红色金属,则B可能为S
④若C的溶液中滴加铁氰化钾溶液有蓝色沉淀生成,则B可能为Cl2.
| A、①②④ | B、②④ |
| C、①②③ | D、①② |
在密闭容器中,一定量混合气体发生下列反应:aA(g)+bB(g)?cC(g)+dD(g) 达到平衡后,测得C气体的浓度为0.5mol/L.当在恒温下,将密闭容器的体积缩小为
,再达平衡时,测得C气体的浓度为0.9mol/L.则下列叙述正确的是( )
| 1 |
| 2 |
| A、反应速率降低 |
| B、平衡向右移动 |
| C、B的转化率提高 |
| D、a+b<c+d |
在一定条件下,将2mol A和1mol B混合于固定容积为2L的密闭容器中,发生如下反应:
,5s时测得气体压强是反应前的
,此段时间内C的平均生成率为( )
| 3A(g)+B(g) |
| xC(g)+2D(g) |
| 5 |
| 6 |
| A、0.25mol/L/s |
| B、0.1 |
| C、0.05mol/(L?s) |
| D、条件不足,无法计算 |
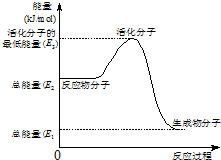 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)→CO2(g)+3H2(g)-49.0kJ
②CH3OH(g)+1/2O2(g)→CO2(g)+2H2(g)+192.9kJ
下列说法正确的是( )
| A、1molCH3OH完全燃烧放出热量192.9 kJ |
| B、②中的能量变化如图所示,则Q=E3-E1 |
| C、H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量 |
| D、根据②推知:在25℃,101 kPa时,1 molCH3OH(g)完全燃烧生成CO2和H2O放出的热量应大于192.9 kJ |
现有CuO和Fe3O4组成的混合物mg,向其中加入2mol/L的稀HCl 100mL,恰好完全反应.若将mg该混合物在足量的H2中加热,使其充分反应后冷却,剩余固体的质量为( )
| A、(m+1.6)g |
| B、1.6m g |
| C、(m-3.2)g |
| D、(m-1.6)g |
 电解装置如图所示.图中B装置盛1L2mol?L-1的Na2SO4溶液,A装置中盛1L2mol?L-1 AgNO3溶液.通电后,湿润的淀粉KI试纸的C端变蓝色.电解一段时间后,试回答:
电解装置如图所示.图中B装置盛1L2mol?L-1的Na2SO4溶液,A装置中盛1L2mol?L-1 AgNO3溶液.通电后,湿润的淀粉KI试纸的C端变蓝色.电解一段时间后,试回答: