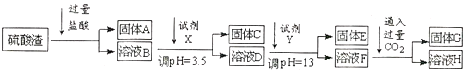
题目内容
M(NO3)2热分解化学方程式为:2M(NO3)2
2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是( )
| ||
| A、64g/mol |
| B、24g/mol |
| C、65g/mol |
| D、40g/mol |
考点:摩尔质量
专题:计算题
分析:根据n=
计算混合气体的物质的量,根据方程式化学计量数关系计算出29.6g M(NO3)2的物质的量,根据M=
计算出摩尔质量,进而根据质量守恒定律计算M的摩尔质量.
| V |
| Vm |
| m |
| n |
解答:
解:在标准状况下收集气体体积为11.2L,物质的量为:
mol=0.5mol,
根据反应方程式2M(NO3)2
2MO+4NO2↑+O2↑,可知2molM(NO3)2分解生成5mol气体,
故M(NO3)2的物质的量为:0.5mol×
=0.2mol,M(NO3)2的摩尔质量为:
=148g/mol,
所以M的相对原子量为:148-62×2=24,
所以M的摩尔质量为:24g/mol,
故选B.
| 11.2L |
| 22.4L/mol |
根据反应方程式2M(NO3)2
| ||
| ||
故M(NO3)2的物质的量为:0.5mol×
| 2 |
| 4+1 |
| 29.6g |
| 0.2mol |
所以M的相对原子量为:148-62×2=24,
所以M的摩尔质量为:24g/mol,
故选B.
点评:本题考查了摩尔质量的计算,题目难度不大,要求熟练掌握物质的量与气体摩尔体积、摩尔质量之间的转化关系.

练习册系列答案
相关题目
浙江海洋经济发展示范区建设已上升为国家战略,海洋经济将成为浙江经济转型升级发展的重点.下列说法不正确的是( )
| A、从海水中提取溴单质的过程中涉及氧化还原反应 |
| B、从海带中提取碘单质的过程中涉及置换反应 |
| C、从海水中提取氯化钠的过程中涉及化学反应 |
| D、电解饱和食盐水制氯气的过程中涉及氧化还原反应 |
下列现象的产生与人为排放大气污染物氮氧化物无关的是( )
| A、闪电 | B、光化学烟雾 |
| C、酸雨 | D、臭氧层空洞 |
同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是( )
| A、电子数之比1:1 |
| B、体积比16:11 |
| C、密度比16:11 |
| D、氧原子数之比为1:1 |
用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A、16g氧气和臭氧(O3)的混合气体所含原子数为NA |
| B、0.1molN5+离子中所含电子数为3.4NA |
| C、如果22.4 L的气体含有NA个分子,则必定是在标准状况下 |
| D、常温常压下,44gCO2中含有NA个CO2分子 |
下列反应的离子方程式正确的是( )
| A、氢氧化钡中加入稀硫酸:Ba2++OH-+SO42-+H+=BaSO4↓+H2O |
| B、氧化铜溶于稀硫酸:2H++CuO=Cu2++H2O |
| C、碳酸钙溶于盐酸:CO32-+2H+=CO2↑+H2O |
| D、铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+ |
下列离子方程式书写正确的是( )
| A、向稀硫酸中加入氢氧化钡溶液 H++SO42-+Ba2++HO-=H2O+BaSO4↓ |
| B、向石灰水中加入硝酸溶液 H++OH-=H2O |
| C、向氧化镁中加入硫酸溶液 Mg2++SO42-=MgSO4 |
| D、向硝酸银溶液中加入锌粉 Zn+Ag+=Zn2++Ag |