题目内容
用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A、16g氧气和臭氧(O3)的混合气体所含原子数为NA |
| B、0.1molN5+离子中所含电子数为3.4NA |
| C、如果22.4 L的气体含有NA个分子,则必定是在标准状况下 |
| D、常温常压下,44gCO2中含有NA个CO2分子 |
考点:阿伏加德罗常数
专题:
分析:A.氧气和臭氧分子中都只含有氧原子,16g二者的混合物中含有16g氧原子,含有1mol氧原子;
B.N5+离子中含有34个电子,0.1mol该离子中含有3.4mol电子;
C.温度和压强影响气体体积,不是标况下,气体摩尔体积有可能为22.4L/mol;
D.根据n=
计算出二氧化碳的物质的量,然后计算出含有的分子数.
B.N5+离子中含有34个电子,0.1mol该离子中含有3.4mol电子;
C.温度和压强影响气体体积,不是标况下,气体摩尔体积有可能为22.4L/mol;
D.根据n=
| m |
| M |
解答:
解:A.16g氧气和臭氧(O3)的混合气体中含有16g氧原子,含有氧原子的物质的量为1mol,混合气体所含原子数为NA,故A正确;
B.0.1molN5+离子中含有电子的物质的量为:34×0.1mol=3.4mol,所含电子数为3.4NA,故B正确;
C.NA个分子的物质的量为1mol,由于温度和压强都影响气体体积,所以适当改变温度和压强,不在标况下1mol气体的体积也可以为22.4L,故C错误;
D.44g二氧化碳的物质的量为1mol,含有NA个CO2分子,故D正确;
故选C.
B.0.1molN5+离子中含有电子的物质的量为:34×0.1mol=3.4mol,所含电子数为3.4NA,故B正确;
C.NA个分子的物质的量为1mol,由于温度和压强都影响气体体积,所以适当改变温度和压强,不在标况下1mol气体的体积也可以为22.4L,故C错误;
D.44g二氧化碳的物质的量为1mol,含有NA个CO2分子,故D正确;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确分子、原子、原子核内质子中子及核外电子的构成关系,选项C为易错点,注意不在标况下气体摩尔体积也可能为22.4L/mol,试题有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
在5NH4NO3═2HNO3+4N2↑+9H2O中,发生氧化反应的氮原子和发生还原反应的氮原子的质量比是( )
| A、1:1 | B、3:5 |
| C、5:3 | D、2:8 |
下列关于钠的叙述正确的是( )
| A、2.3 g钠与97.7 g水反应后溶液中溶质的质量分数大于4% |
| B、钠跟CuSO4溶液反应生成的蓝色沉淀上有时会出现暗斑,这是因为析出了金属铜的缘故 |
| C、钠在化学反应中常常失去电子被氧化,做氧化剂,故Na+具有强氧化性 |
| D、钠、钾是低熔点的轻金属,所以钠、钾合金在常温时柔软似蜡 |
由CH4和CO组成的混合气体,在标准状况下的密度为1g?L-1,则混合气体中CH4和CO的质量比为( )
| A、1:1 | B、1:2 |
| C、2:3 | D、7:8 |
下列说法正确的是( )
| A、同温同压下,相同体积的物质,其物的量一定相等 |
| B、标准状况下气体摩尔体积约为22.4L |
| C、0.5L1 mol/L FeCl3溶液与0.2L 1 mol/L KCl溶液中的Cl-的数目之比为15:2 |
| D、100m1 mol/L NaCl溶液与50mL 1 mol/L AlCl3溶中Cl-物质的量浓度相等 |
M(NO3)2热分解化学方程式为:2M(NO3)2
2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是( )
| ||
| A、64g/mol |
| B、24g/mol |
| C、65g/mol |
| D、40g/mol |
下列反应的化学方程式或离子方程式表示正确的是( )
A、溴乙烷与氢氧化钠溶液共热:C2H5Br+OH-
| ||
| B、苯酚钠溶液和少量CO2反应:2C6H5O-+CO2+H2O=2C6H5OH+CO32- | ||
| C、用醋酸去除水垢:CaCO3+2H+=Ca2++CO2↑+H2O | ||
D、用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH4)2OH
|
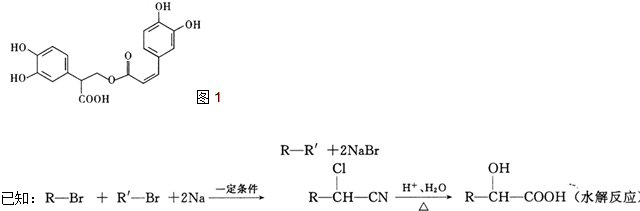
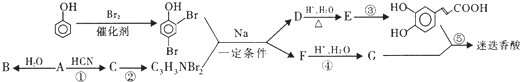
 化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式C8H8O2.其核磁共振氢谱与红外光谱如图,核磁共振氢谱面积之比为3:2:2:1.
化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式C8H8O2.其核磁共振氢谱与红外光谱如图,核磁共振氢谱面积之比为3:2:2:1.