题目内容
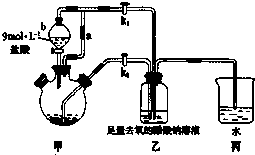
15.S2C12在工业上用作橡胶硫化剂.实验室利用下列装置(部分夹持仪器己略去),将干燥纯净的Cl2通入CS2液体中制备S2C12:CS2+3C12$\frac{\underline{\;95℃~100℃\;}}{\;}$CCl4+S2C12.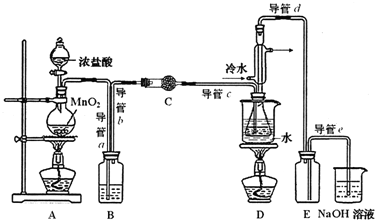
已知:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| S | 113 | 444 | 1.96 | 不溶于水 |
| S2C12 | -76 | 138 | 1.75 | 与水反应 |
| C S2 | -109 | 47 | 1.26 | 不溶于水 |
| CC14 | -23 | 77 | 1.59 | 不溶于水 |
①通入C12 ②熄灭装置A中酒精灯 ③通入冷水
④关闭冷水 ⑤加热装置D ⑥熄灭装置D中酒精灯
(2)为获得平缓稳定的Cl2气流,A装置的操作是控制分液漏斗下端的活塞,使浓盐酸匀速滴下.
(3)装置C中盛有的试剂是无水CaCl2(或P2O5).
(4)装置D中冷凝管的作用是导气、冷凝回流.
(5)实验过程中,若缺少C装置,则产品浑浊不清并产生2种酸性气体,写出其反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.
(6)制备结束后,为从粗产品(含S2C12,CCl4、CS2)中提纯S2C12,从上图所示仪器装置中选取部分,简述仪器改装及操作方案将导管d用单孔橡皮塞与锥形瓶连接,水浴加热(至煮沸).
分析 制取原理是:显示二氧化锰和浓盐酸之间反应得到氯气,但是氯气中混油HCl和水,应该先用饱和食盐水除去HCl,再用无水CaCl2(或P2O5)干燥氯气,让氯气和二硫化碳在一定温度下发生反应:CS2+3C12$\frac{\underline{\;95℃~100℃\;}}{\;}$CCl4+S2C12,为了使CS2平稳汽化,避免产物S2Cl2汽化,采用热水浴加热的方法,根据S2Cl2的熔沸点数据,采用冷凝回流的办法将之收集即可,实验中用E装置作安全瓶,可以防倒吸,氯气要进行尾气处理,可以用氢氧化钠来吸收,据此答题;
解答 解:制取原理是:显示二氧化锰和浓盐酸之间反应得到氯气,但是氯气中混油HCl和水,应该先用饱和食盐水除去HCl,再用无水CaCl2(或P2O5)干燥氯气,让氯气和二硫化碳在一定温度下发生反应:CS2+3C12$\frac{\underline{\;95℃~100℃\;}}{\;}$CCl4+S2C12,为了使CS2平稳汽化,避免产物S2Cl2汽化,采用热水浴加热的方法,根据S2Cl2的熔沸点数据,采用冷凝回流的办法将之收集即可,实验中用E装置作安全瓶,可以防倒吸,氯气要进行尾气处理,可以用氢氧化钠来吸收,
(1)根据上面的分析可知,该实验的操作先后顺序为先通入冷水、通入C12、加热装置D、熄灭装置D中酒精灯、熄灭装置A中酒精灯、关闭冷水,故顺序为①⑤⑥②④,
故答案为:①⑤⑥②④;
(2)根据上面的分析可知,为获得平缓稳定的Cl2气流,A装置的操作是控制分液漏斗下端的活塞,使浓盐酸匀速滴下,
故答案为:控制分液漏斗下端的活塞,使浓盐酸匀速滴下;
(3)装置C中盛有的试剂是无水CaCl2(或P2O5),
故答案为:无水CaCl2(或P2O5);
(4)根据上面的分析可知,装置D中冷凝管的作用是导气、冷凝回流,
故答案为:导气、冷凝回流;
(5)实验过程中,若缺少C装置,则装置中有水,S2Cl2会发生水解,产品中有硫产生而浑浊不清,并产生2种酸性气体为二氧化硫和氯化氢,其反应的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑,
故答案为:2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑;
(6)从粗产品(含S2C12,CCl4、CS2)中提纯S2C12,可以用蒸馏的方法,根据S2C12的沸点可知,可以用水浴加热的方法,所以在上图中仪器改装及操作方案是将导管d用单孔橡皮塞与锥形瓶连接,水浴加热(至煮沸),
故答案为:将导管d用单孔橡皮塞与锥形瓶连接,水浴加热(至煮沸).
点评 本题考查了氯气实验室制备方法,杂质气体除杂的装置选择和试剂选择,题干信息的应用分析,电子式书写,化学方程式书写方法,混合物分离的方法判断,题目难度中等.

| A. | 金属铝在生产、生活中得到广泛的应用,主要是因为其可用热还原法冶炼 | |
| B. | 对“地沟油”蒸馏可以获得汽油 | |
| C. | 氯气常用于自来水的消毒,是利用了氯气的强氧化性来杀菌消毒 | |
| D. | 化石燃料使用过程中排放的硫、氮的氧化物是形成酸雨的主要原因 |
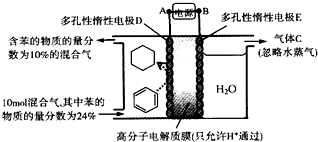
| A. | 多孔性惰性电极E为电解池的阴极 | |
| B. | 装置中气体C为氢气 | |
| C. | 由A至D,导线中电子转移方向为D→A | |
| D. | 装置中阴极的电极反应式为C6H6+6H++6e-═C6H12 |
| A. | H2、SO2、CO2三种气体都可用浓硫酸干燥 | |
| B. | Fe(OH)3胶体为无色、透明,能发生丁达尔现象 | |
| C. | 在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 | |
| D. | SiO2既能和氢氟酸反应又能和氢氧化钠溶液反应,所以是两性氧化物 |
【查阅资料】
| 苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
| 熔点/℃ | 122.4 | -114.1 | -34.6 |
| 沸点/℃ | 249 | 78.3 | 212.6 |
| 密度/g•cm-3 | 1.2659 | 0.816 | 1.05 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
①将粗苯甲酸加到烧杯中,再加入蒸馏水,边加热边搅拌,使粗苯甲酸完全溶解.
②再加入少量蒸馏水并搅拌.
③趁热过滤,静置,冷却结晶.
④滤出晶体.
(1)以上各步中均要用到的玻璃仪器是烧杯、玻璃棒.
(2)已知温度越低,苯甲酸的溶解度越小.为了得到更多的苯甲酸晶体,有同学认为结晶的温度越低越好,你认为是否正确?否(填“是”或“否”),原因是温度过低,杂质可能结晶析出,达不到提纯苯甲酸的目的.
【合成粗产品】
苯甲酸和乙醇在浓硫酸作用下加热反应可得苯甲酸乙酯粗产品.
(3)欲提高苯甲酸的转化率,可以采取的措施是加入过量的乙醇或移去苯甲酸乙酯(任答1点).
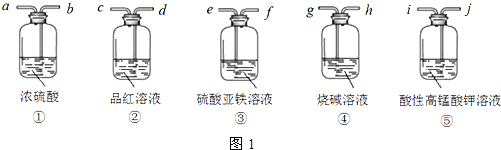
(4)该小组同学认为本实验中可能的气体副产物有乙烯、二氧化硫等,从下列装置中选出必要的装置检验乙烯,正确的连接顺序为:气体副产物→ghdcj(填接口字母编号).
【精制粗产品】
苯甲酸乙酯粗产品中往往含有少量乙醇、硫酸、苯甲酸和水等,精制的流程图如图2:
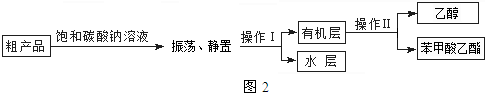
(5)操作Ⅱ的名称是蒸馏.
(6)上述精制过程中饱和碳酸钠溶液的作用是溶解乙醇、除去(或反应)酸性物质、降低酯的溶解度.
 .
.  .
. .
. .
.
 醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种为红棕色晶体,极易被氧气氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂).
醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种为红棕色晶体,极易被氧气氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂). 为探究生活中两种常见的有机物的性质,某同学设计如下实验,请根据题目要求回答下列问题:
为探究生活中两种常见的有机物的性质,某同学设计如下实验,请根据题目要求回答下列问题: