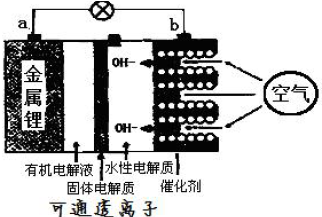
题目内容
4.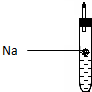 为探究生活中两种常见的有机物的性质,某同学设计如下实验,请根据题目要求回答下列问题:
为探究生活中两种常见的有机物的性质,某同学设计如下实验,请根据题目要求回答下列问题:(1)如图所示,试管中装乙醇,据此,请你任写一点该探究实验产生的现象钠沉于无水酒精底部,反应缓慢,表面有气泡.
(2)用食醋浸泡附有水垢(主要成分CaCO3)的水壶,可以除去水垢,说明酸性:醋酸>碳酸.(填“>”或“<”)
分析 (1)Na与乙醇反应生成乙醇钠和氢气,但钠的密度大于水;
(2)醋酸与碳酸钙反应生成醋酸钙、二氧化碳、水,属于强酸制取弱酸的反应.
解答 解:(1)钠与乙醇反应的现象:钠沉于无水酒精底部,不熔成闪亮的小球,也不发出响声,反应缓慢,表面有气泡,
故答案为:钠沉于无水酒精底部,反应缓慢,表面有气泡;
(2)醋酸与碳酸钙反应生成醋酸钙、二氧化碳、水,由强酸制取弱酸的反应原理可知,则酸性为醋酸>碳酸;
故答案为:>.
点评 本题考查有机物性质实验方案,把握物质的性质及实验中发生的化学反应为解答的关键,题目难度不大.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
14.不属于空气污染物的是( )
| A. | NO2 | B. | CO | C. | C6H6(g) | D. | CO2 |
15.S2C12在工业上用作橡胶硫化剂.实验室利用下列装置(部分夹持仪器己略去),将干燥纯净的Cl2通入CS2液体中制备S2C12:CS2+3C12$\frac{\underline{\;95℃~100℃\;}}{\;}$CCl4+S2C12.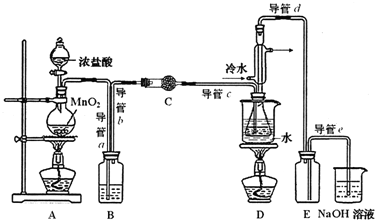
已知:
(1)该实验的操作先后顺序为:③①⑤⑥②④(用序号表示).
①通入C12 ②熄灭装置A中酒精灯 ③通入冷水
④关闭冷水 ⑤加热装置D ⑥熄灭装置D中酒精灯
(2)为获得平缓稳定的Cl2气流,A装置的操作是控制分液漏斗下端的活塞,使浓盐酸匀速滴下.
(3)装置C中盛有的试剂是无水CaCl2(或P2O5).
(4)装置D中冷凝管的作用是导气、冷凝回流.
(5)实验过程中,若缺少C装置,则产品浑浊不清并产生2种酸性气体,写出其反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.
(6)制备结束后,为从粗产品(含S2C12,CCl4、CS2)中提纯S2C12,从上图所示仪器装置中选取部分,简述仪器改装及操作方案将导管d用单孔橡皮塞与锥形瓶连接,水浴加热(至煮沸).

已知:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| S | 113 | 444 | 1.96 | 不溶于水 |
| S2C12 | -76 | 138 | 1.75 | 与水反应 |
| C S2 | -109 | 47 | 1.26 | 不溶于水 |
| CC14 | -23 | 77 | 1.59 | 不溶于水 |
①通入C12 ②熄灭装置A中酒精灯 ③通入冷水
④关闭冷水 ⑤加热装置D ⑥熄灭装置D中酒精灯
(2)为获得平缓稳定的Cl2气流,A装置的操作是控制分液漏斗下端的活塞,使浓盐酸匀速滴下.
(3)装置C中盛有的试剂是无水CaCl2(或P2O5).
(4)装置D中冷凝管的作用是导气、冷凝回流.
(5)实验过程中,若缺少C装置,则产品浑浊不清并产生2种酸性气体,写出其反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.
(6)制备结束后,为从粗产品(含S2C12,CCl4、CS2)中提纯S2C12,从上图所示仪器装置中选取部分,简述仪器改装及操作方案将导管d用单孔橡皮塞与锥形瓶连接,水浴加热(至煮沸).
12.合成氨的流程示意图如下.
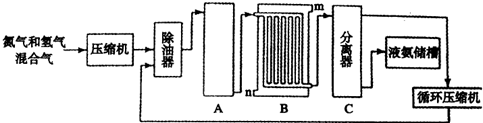
请回答下列问题.
(1)设备A中含有电加热器,触媒和热交换器,其中发生的化学反应方程式为N2+3H2 2NH3,设备A的名称是合成塔;
2NH3,设备A的名称是合成塔;
(2)设备B中m和n是两个通水口,入水口是n(填“m”或“n”);不宜从相反方向通水的原因是高温气体从冷却塔的上端进入,冷却水应从下端进入,逆向冷却效果好.
(3)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是液化,分馏.
(4)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
①依据上表信息,你认为采用天然气为原料最好.
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:CH4+H2O$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CO+3H2.
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g)△H=-394kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式C(S)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g) △H=+131KJ/mol.
(5)在合成氨生产中,将生成的氨及时从反应后的气体中分离出来.运用化学平衡的知识分析这样做的理由:移走氨气,减小生成物浓度,平衡右移,有利于氨合成.

请回答下列问题.
(1)设备A中含有电加热器,触媒和热交换器,其中发生的化学反应方程式为N2+3H2
 2NH3,设备A的名称是合成塔;
2NH3,设备A的名称是合成塔;(2)设备B中m和n是两个通水口,入水口是n(填“m”或“n”);不宜从相反方向通水的原因是高温气体从冷却塔的上端进入,冷却水应从下端进入,逆向冷却效果好.
(3)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是液化,分馏.
(4)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J•t-1 | 28109 | 38109 | 48109 |
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:CH4+H2O$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CO+3H2.
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g)△H=-394kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式C(S)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g) △H=+131KJ/mol.
(5)在合成氨生产中,将生成的氨及时从反应后的气体中分离出来.运用化学平衡的知识分析这样做的理由:移走氨气,减小生成物浓度,平衡右移,有利于氨合成.
19.将锌片和铜片按如图方式插入柠檬中,电流计指针发生偏转.则下列说法中正确的是( )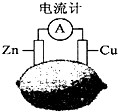

| A. | 该装制能将电能转换为化学能 | B. | 电子由铜片流出经导线到锌片 | ||
| C. | 一段时间后,锌片质量减轻 | D. | 铜片一侧产生Cu2+使柠檬变蓝色 |
16.实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30~35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30min,静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体.
请回答:
(1)反应温度控制在30-35℃,是因为高于35℃NH4HCO3会分解,低于,30℃则反应速率降低,为控制此温度范围,通常采取的加热方法为水浴加热.
(2)加料完毕,保温30min,目的使反应充分进行.
(3)静置后只析出NaHCO3晶体的原因NaHCO3的溶解度最小.
(4)过滤所得母液中含有NaHCO3、NaCl、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使NaCl(填化学式)循环使用,回收得到NH4Cl晶体.
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
(1)反应温度控制在30-35℃,是因为高于35℃NH4HCO3会分解,低于,30℃则反应速率降低,为控制此温度范围,通常采取的加热方法为水浴加热.
(2)加料完毕,保温30min,目的使反应充分进行.
(3)静置后只析出NaHCO3晶体的原因NaHCO3的溶解度最小.
(4)过滤所得母液中含有NaHCO3、NaCl、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使NaCl(填化学式)循环使用,回收得到NH4Cl晶体.
14.将一铜片在酒精灯火焰上加热后,分别插入下列溶液中,取出洗涤、干燥、称量.与厚铜片相比质量变化正确的有( )
①醋酸 ②甲醇 ③石灰水.
①醋酸 ②甲醇 ③石灰水.
| A. | ①变轻,②变重,③不变 | B. | ①变轻,②不变,③变重 | ||
| C. | ①变轻,②不变,③不变 | D. | ①变重,②不变,③变轻 |