题目内容
25℃时,某强酸溶液pH=a,强碱溶液pH=b,且a+b=13,酸碱溶液混合后溶液的pH=7,则酸溶液的体积(V1)与碱溶液的体积(V2)的关系是( )
| A、V1=10V2 |
| B、V1=2V2 |
| C、V2=10V1 |
| D、V2=2 V1 |
考点:pH的简单计算
专题:
分析:25℃时,Kw=10-14,某强酸溶液pH=a,则该酸溶液中氢离子浓度为10-a mol/L,强碱溶液pH=b,则碱溶液中氢氧根离子浓度=10 b-14 mol/L,溶液呈中性说明氢离子和氢氧根离子的物质的量相等.
解答:
解:25℃时,Kw=10-14,某强酸溶液pH=a,则该酸溶液中氢离子浓度为10-a mol/L,强碱溶液pH=b,则碱溶液中氢氧根离子浓度=10 b-14 mol/L,溶液呈中性说明氢离子和氢氧根离子的物质的量相等,设酸的体积为V1,碱的体积为V2,10-a mol/L×V1L=10 b-14 mol/L×V2L,则V1=10 a+b-14 V2,而a+b=13,故V2=10V2,故选C.
点评:本题考查了离子积常数的有关计算,根据溶液的酸碱性及水的离子积常数来分析解答,注意该温度下水的离子积常数是10-14,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
生产、生活离不开各种化学物质,下列说法不正确的是( )
| A、氧化铝可以用来制造耐火坩埚、耐火管和耐高温的实验仪器 |
| B、潜水艇在紧急情况下可用过氧化钠供氧 |
| C、氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 |
| D、工业上常用硅制造光导纤维 |
为了验证NaHCO3固体中是否含有Na2CO3,下列实验及判断中,正确的是( )
| A、加热,观察是否有气体放出 |
| B、溶于水后加BaC12,看有无沉淀 |
| C、溶于水后加石灰水,看有无沉淀 |
| D、取固体变色试样加盐酸,看是否有气泡产生 |
对于弱电解质的稀溶液,温度一定时,加水稀释至原来浓度的1/n时,其电离度将增大到原溶液电离度的
倍,现有pH=2的某一元弱酸溶液10mL,加水稀释至1L后,溶液的pH( )
| n |
| A、等于4 | B、在3~4之间 |
| C、等于3 | D、在2~3之间 |
把0.05mol NaOH固体分别加入下列100mL液体中,溶液导电能力变化不大的是( )
| A、自来水 |
| B、0.5mol/L盐酸 |
| C、0.5mol/LCH3COOH |
| D、0.5mol/LNH4Cl溶液 |
实验室用足量镁粉与一定量的某浓度的盐酸反应来制得氢气.由于反应速率太快,不易操作.为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是( )
| A、CH3COONa固体 |
| B、NaOH溶液 |
| C、(NH4)2SO4粉末 |
| D、K2SO4固体 |
下列化学用语书写正确的是( )
A、氯原子的结构示意图: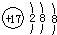 | ||
B、作为相对原子质量测定标准的碳核素:
| ||
C、氯化镁的电子式: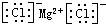 | ||
| D、乙烯的结构简式:CH2CH2 |

