题目内容
对于弱电解质的稀溶液,温度一定时,加水稀释至原来浓度的1/n时,其电离度将增大到原溶液电离度的
倍,现有pH=2的某一元弱酸溶液10mL,加水稀释至1L后,溶液的pH( )
| n |
| A、等于4 | B、在3~4之间 |
| C、等于3 | D、在2~3之间 |
考点:pH的简单计算
专题:
分析:加水稀释到1L后,物质的量浓度变为原来的0.01倍,电离度就是增大了10倍,体积增大了100倍.
解答:
解:加水稀释到1L后,物质的量浓度变为原来的0.01倍,所以m=100,那么电离度就是增大了10倍,体积增大了100倍,所以c(H+)=10-2×
=10-3.
故选C.
| 10 |
| 100 |
故选C.
点评:本题考查pH的简单计算,为高频考点,侧重于学生的分析能力和计算能力的考查,难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
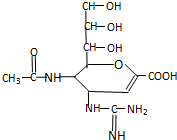 已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性.其分子结构如图:下列说法正确的是( )
已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性.其分子结构如图:下列说法正确的是( )| A、该物质的分子式为C12H19N4O7 |
| B、在一定条件下,该物质可以发生消去、加成、取代等反应 |
| C、1mol该物质与NaOH溶液反应,可以消耗4molNaOH |
| D、该物质能使溴水或高锰酸钾溶液褪色,能与FeCl3溶液发生显色反应 |
在锌与盐酸的反应中,HCl( )
| A、发生氧化反应 | B、是还原剂 |
| C、是氧化剂 | D、表现还原性 |
工业上,用辉铜矿(Cu2S)炼铜的方法之一是:①将矿石在高温下鼓入空气煅烧,生成两种氧化物;②将煅烧过的矿石加上比它质量约少一半的未经煅烧过的矿石,混合后隔绝空再进行高温煅烧,结果得到铜和一种有刺激性气味的气体.下列对反应①和②的推断不正确的是( )
| A、反应①和②的氧化产物都是S02 |
| B、反应①的氧化产物与还原产物物质的量之比为1:1 |
| C、等物质的量的硫化亚铜在反应①和②中完全反应,转移的电子数相等 |
| D、反应②中,硫化亚铜既是氧化剂又是还原剂 |
25℃时,某强酸溶液pH=a,强碱溶液pH=b,且a+b=13,酸碱溶液混合后溶液的pH=7,则酸溶液的体积(V1)与碱溶液的体积(V2)的关系是( )
| A、V1=10V2 |
| B、V1=2V2 |
| C、V2=10V1 |
| D、V2=2 V1 |

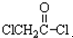 与足量的NaOH溶液共热充分反应的化学方程式:
与足量的NaOH溶液共热充分反应的化学方程式: